Opløses magnesiumhydroxid i vand?
Her er hvorfor:
* ionisk forbindelse: Mg (OH) ₂ er en ionisk forbindelse, hvilket betyder, at den danner ioner, når det opløses i vand.
* lav opløselighed: Opløseligheden af Mg (OH) ₂ er ret lav. Dette betyder, at kun en lille mængde Mg (OH) ₂ dissocieres i dens ioner (mg²⁺ og OH⁻), når den tilsættes til vand.
* ligevægt: Opløsningen af Mg (OH) ₂ er en ligevægtsreaktion. Processen med opløsning og processen med ionerne, der rekombineres tilbage til fast Mg (OH) ₂ sker samtidig. Den lave opløselighed betyder, at ligevægten ligger stærkt over for den faste Mg (OH) ₂ side.
Imidlertid kan opløseligheden af Mg (OH) ₂ øges med:
* syrer: Syrer reagerer med hydroxidioner (OH⁻) for at danne vand og skifte ligevægt mod yderligere opløsning af Mg (OH) ₂. Dette er grunden til, at magnesiumhydroxid bruges som et antacida.
* Forøget temperatur: Opløselighed øges generelt med temperaturen. Mens effekten er lille for Mg (OH) ₂, vil en lidt højere temperatur resultere i en lidt højere koncentration af opløste ioner.
generelt: Mens Mg (OH) ₂ opløses til en vis grad i vand, betragtes det praktisk talt uopløseligt. Dens lave opløselighed skyldes den stærke tiltrækning mellem Mg²⁺ og OH⁻ioner, som holder det meste af forbindelsen i dens faste form.
Sidste artikelHvorfor butikker kemisk obligation den mest energi?
Næste artikelHvad er CH2CHCH2CH3?
 Varme artikler
Varme artikler
-
 Porøse polymerbelægninger styrer lys og varme dynamiskDe porøse polymerbelægninger, der skifter fra hvidt til gennemsigtigt, når det er fugtet, kan sættes i plastikskabe for at lave paneler, der styrer lys og temperaturer i bygninger. Kredit:Jyotirmoy Ma
Porøse polymerbelægninger styrer lys og varme dynamiskDe porøse polymerbelægninger, der skifter fra hvidt til gennemsigtigt, når det er fugtet, kan sættes i plastikskabe for at lave paneler, der styrer lys og temperaturer i bygninger. Kredit:Jyotirmoy Ma -
 Kemikere tester Chematicas evne til at generere syntetiske ruterEt team af kemikere, der arbejder for MilliporeSigma, et firma, der købte Chematica, et computerprogram, der genererer syntetiske ruter (den række reaktioner, der er nødvendige for at skabe et synteti
Kemikere tester Chematicas evne til at generere syntetiske ruterEt team af kemikere, der arbejder for MilliporeSigma, et firma, der købte Chematica, et computerprogram, der genererer syntetiske ruter (den række reaktioner, der er nødvendige for at skabe et synteti -
 Nye molekylære designs frigør det terapeutiske potentiale af nikotinreceptorerModificerede cytisinmolekyler (fuchsia) bundet til hjernens vigtigste nikotinreceptor. Kredit:Dr. Sofia Oliveira, University of Bristol Syv millioner mennesker dør hvert år af rygerelaterede sygdo
Nye molekylære designs frigør det terapeutiske potentiale af nikotinreceptorerModificerede cytisinmolekyler (fuchsia) bundet til hjernens vigtigste nikotinreceptor. Kredit:Dr. Sofia Oliveira, University of Bristol Syv millioner mennesker dør hvert år af rygerelaterede sygdo -
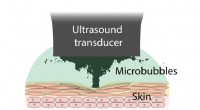 Brug af lyd og bobler til at gøre bandager mere klæbrige og holder længereUltralydsinducerede mikrobobler medierer bioadhæsion. Kredit:Zhenwei Ma Forskere har opdaget, at de kan kontrollere klæbrigheden af klæbende bandager ved hjælp af ultralydsbølger og bobler. Dette
Brug af lyd og bobler til at gøre bandager mere klæbrige og holder længereUltralydsinducerede mikrobobler medierer bioadhæsion. Kredit:Zhenwei Ma Forskere har opdaget, at de kan kontrollere klæbrigheden af klæbende bandager ved hjælp af ultralydsbølger og bobler. Dette
- Sandt eller falske to celler produceret under den første cytokinesis hos kvindelige dyr er tilnærm…
- Digital skatteaftale fungerer, men nøglespørgsmål udestående:OECD
- Undersøgelse binder fosforbelastning i søer til ekstreme nedbørshændelser
- Hvordan genomdiversiteten af store afgrøder fortæller historien om deres udvikling
- Når en styrke på 5 Newton handler parallelt med øjeblikket Arm 10 cm. Så hvilket drejningsmoment…
- Hvad er grunden til et topografisk kort?


