Hvordan adskiller en ideel gas sig fra en ægte gas?
Ideel gas:
* antagelser:
* Punktpartikler: Gasmolekyler anses for ikke at have noget volumen, bare et punkt i rummet.
* Ingen intermolekylære kræfter: Molekyler tiltrækker ikke eller afviser hinanden.
* Elastiske kollisioner: Kollisioner mellem molekyler er perfekt elastiske, hvilket betyder, at ingen energi går tabt.
* Tilfældig bevægelse: Molekyler bevæger sig tilfældigt i alle retninger i høje hastigheder.
* adfærd:
* Følger Ideal Gas Law (PV =NRT) perfekt.
* Kompressibilitet er meget høj.
* Den interne energi i en ideel gas skyldes udelukkende dens kinetiske energi.
* Der er ingen kondens eller flydende virkning, selv ved lave temperaturer og høje tryk.
Ægte gas:
* virkelighed:
* Finit volumen: Molekyler har volumen, og dette volumen kan være betydningsfuldt ved høje tryk.
* Intermolekylære kræfter: Molekyler tiltrækker hinanden (van der Waals -kræfter), og dette bliver betydeligt ved lave temperaturer og høje tryk.
* Inelastiske kollisioner: Kollisioner mellem molekyler er ikke perfekt elastiske, og en vis energi går tabt.
* adfærd:
* Afvigelser fra den ideelle gaslov bliver betydelige ved høje tryk og lave temperaturer.
* Kompressibilitet er lavere end en ideel gas.
* Den interne energi i en ægte gas inkluderer både kinetisk energi og potentiel energi på grund af intermolekylære kræfter.
* Kondensation og likvidation kan forekomme ved lave temperaturer og høje tryk.
Kortfattet:
| Funktion | Ideel gas | Ægte gas |
| --- | --- | --- |
| Molekylstørrelse | Punktpartikler (nulvolumen) | Endelig volumen |
| Intermolekylære kræfter | Ingen | Nuværende (van der Waals Forces) |
| Kollisioner | Perfekt elastisk | Uelastisk |
| Ideel gaslov | Følger perfekt | Afvigelser ved højt tryk og lav temperatur |
| Kompressibilitet | Høj | Lavere end ideel gas |
| Kondensation/Liquefaction | Ikke muligt | Mulig ved lav temperatur og højt tryk |
Hvornår skal man bruge den ideelle gasmodel:
Den ideelle gasmodel er en nyttig tilnærmelse for de fleste gasser ved moderate temperaturer og tryk. Når forholdene imidlertid afviger markant fra disse, skal den virkelige gasmodel bruges til nøjagtigt at forudsige gasens opførsel.
Eksempler:
* ideel gas: Helium ved stuetemperatur og tryk opfører sig næsten som en ideel gas.
* Ægte gas: Vanddamp ved højt tryk og lav temperatur opfører sig markant forskelligt fra en ideel gas.
Husk, at den ideelle gasmodel er en forenkling, der giver et godt udgangspunkt for forståelse af gasadfærd. Den virkelige gasmodel tilbyder en mere nøjagtig repræsentation, når man overvejer kompleksiteten af molekylære interaktioner.
Sidste artikelHvorfor tilføjes kalk i smelteprocessen?
Næste artikelHvad kaldes lige koncentration?
 Varme artikler
Varme artikler
-
 Når flere knogledannende celler er lig med mindre knogleForskere ved UConn Health har vist, hvordan et muteret gen forårsager overskydende knogleresorption i en sjælden knoglesygdom kendt som Lehmans syndrom. Deres forskning er forsideartiklen i 7. septemb
Når flere knogledannende celler er lig med mindre knogleForskere ved UConn Health har vist, hvordan et muteret gen forårsager overskydende knogleresorption i en sjælden knoglesygdom kendt som Lehmans syndrom. Deres forskning er forsideartiklen i 7. septemb -
 Små broer hjælper partikler med at holde sammenKredit:CC0 Public Domain Det sker uden for dit vindue, hver gang det regner:Jorden bliver våd og kan danne klistret mudder. Så tørrer det. Senere kan det regne igen. Hver befugtning og genfugtning
Små broer hjælper partikler med at holde sammenKredit:CC0 Public Domain Det sker uden for dit vindue, hver gang det regner:Jorden bliver våd og kan danne klistret mudder. Så tørrer det. Senere kan det regne igen. Hver befugtning og genfugtning -
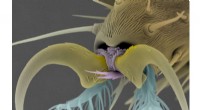 Lavpris, fluetrædepude-lignende klæbestruktur, der er i stand til gentagen fastgørelse/aftagningElektronmikrografi af fluefoden. De klæbende spatelformede setae (lyseblå strukturer) gør det muligt for fluen at sætte sig fast på genstande. Kredit:Hokkaido University of Education NIMS, HUE og
Lavpris, fluetrædepude-lignende klæbestruktur, der er i stand til gentagen fastgørelse/aftagningElektronmikrografi af fluefoden. De klæbende spatelformede setae (lyseblå strukturer) gør det muligt for fluen at sætte sig fast på genstande. Kredit:Hokkaido University of Education NIMS, HUE og -
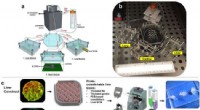 Forskere udvikler body-on-a-chip-system til at fremskynde test af nye lægemidlerOverordnet design- og implementeringsstrategi for det 3-vævsrepræsentative organ-på-en-chip-system ved hjælp af en række biofabrikationstilgange. (en, b) Illustration og fotografi af det modulære mult
Forskere udvikler body-on-a-chip-system til at fremskynde test af nye lægemidlerOverordnet design- og implementeringsstrategi for det 3-vævsrepræsentative organ-på-en-chip-system ved hjælp af en række biofabrikationstilgange. (en, b) Illustration og fotografi af det modulære mult
- Coho laks dør, chum laks overlever i stormvandafstrømningsforskning
- Hvad betyder leder, hvad betyder isolator?
- Hvilken af disse har størst effekt på et økosystem F. samfund H. klima G. biotiske faktorer. J.…
- Mexico erkender, at banker blev hacket; tab ukendt
- Druegenetikforskning afslører, hvad der gør den perfekte blomst
- ExoMars fremhæver strålingsrisiko for Mars -astronauter, og ser efterhånden som støvstorm aftage…


