Hvilke forskelle ville blive observeret, hvis HCL blev brugt i stedet for NA OH med den sure bufferopløsning?
Forståelse af sure buffere
* sammensætning: Sure buffere består af en svag syre og dens konjugatbase.
* hvordan de fungerer: Bufferen modstår ændringer i pH, når der tilsættes små mængder syre eller base. Den svage syre reagerer med tilsat base (OH-), og den konjugerede base reagerer med tilsat syre (H+).
HCL vs. NaOH
* NaOH (stærk base): Tilsætning af NaOH til en sur buffer vil neutralisere den svage syre og flytte ligevægten mod konjugatbasen. Dette ville føre til et * fald * i pufferens evne til at modstå yderligere ændringer i pH.
* hcl (stærk syre): Tilsætning af HCI til en sur buffer vil neutralisere den konjugatbase og flytte ligevægten mod den svage syre. Dette ville også * mindske * pufferens evne til at modstå yderligere ændringer i pH.
Nøgleforskelle
Den største forskel mellem at bruge HCL og NaOH er retningen af ligevægtsskiftet:
* naoh: Flytter ligevægten mod den konjugatbase.
* hcl: Flytter ligevægten mod den svage syre.
påvirkning af pH
* naoh: Opløsningens pH vil øges (bliver mere grundlæggende), da pufferens kapacitet til at neutralisere tilsat base reduceres.
* hcl: Opløsningens pH vil falde (blive mere sur), når pufferens kapacitet til at neutralisere tilsat syre reduceres.
Praktiske implikationer
* Bufferkapacitet: Både HCL og NaOH vil * reducere * bufferkapaciteten for en sur bufferopløsning. Dette betyder, at pufferen vil være mindre effektiv til at modstå yderligere ændringer i pH.
* Buffereffektivitet: Effektiviteten af en pufferopløsning bestemmes af dens evne til at opretholde et stabilt pH -område. Brug af enten HCL eller NaOH vil mindske pufferens effektivitet.
Vigtig note: De specifikke ændringer i pH og bufferkapacitet afhænger af koncentrationen af pufferkomponenterne, mængden af HCI eller NaOH tilsat og PKA for den svage syre i bufferen.
 Varme artikler
Varme artikler
-
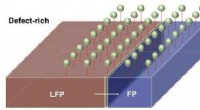 Forskere viser punktdefekter i katodekrystaller kan fremskynde lithiumabsorptionEn illustration viser et batteris katode, der gennemgår faseovergang fra jernfosfat (FP) til lithiumjernfosfat (LFP) under opladning. Simuleringer fra Rice University-forskere viste, at tilføjelse af
Forskere viser punktdefekter i katodekrystaller kan fremskynde lithiumabsorptionEn illustration viser et batteris katode, der gennemgår faseovergang fra jernfosfat (FP) til lithiumjernfosfat (LFP) under opladning. Simuleringer fra Rice University-forskere viste, at tilføjelse af -
 Brændselscelle fremme et frisk pust til fremtidigt kraftalternativFast oxid brændselsceller kan bruges i en række forskellige applikationer, herunder effektiv generering af primær- eller nødstrømforsyning til bygninger. En gruppe Bloom Energy-servere genererer strøm
Brændselscelle fremme et frisk pust til fremtidigt kraftalternativFast oxid brændselsceller kan bruges i en række forskellige applikationer, herunder effektiv generering af primær- eller nødstrømforsyning til bygninger. En gruppe Bloom Energy-servere genererer strøm -
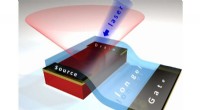 Lys fra en eksotisk krystalhalvleder kan føre til bedre solcellerKonceptuelt billede af en transistorenhed, der styrer fotoluminescens (den lyserøde kegle), der udsendes af en hybrid perovskitkrystal (den røde boks), der exciteres af en blå laserstråle, efter at sp
Lys fra en eksotisk krystalhalvleder kan føre til bedre solcellerKonceptuelt billede af en transistorenhed, der styrer fotoluminescens (den lyserøde kegle), der udsendes af en hybrid perovskitkrystal (den røde boks), der exciteres af en blå laserstråle, efter at sp -
 Forskere udvikler wolfram-baserede brintdetektorerMorfologien af Pt/WOx/SiC-strukturen. Kredit:V.V. Zuyev et al./et brev til Journal of Technical Physics, 2015 Et hold fysikere fra Immanuel Kant Baltic Federal University har sammen med deres ko
Forskere udvikler wolfram-baserede brintdetektorerMorfologien af Pt/WOx/SiC-strukturen. Kredit:V.V. Zuyev et al./et brev til Journal of Technical Physics, 2015 Et hold fysikere fra Immanuel Kant Baltic Federal University har sammen med deres ko
- Trykkogning af birkeblade til fremstilling af råmateriale til organiske halvledere
- Ny æra for New Norcia deep space antenne
- Forskere opnår lovende resultater for kontrol med forurenende stoffer i vand
- Hvad kaldes den tynde væskefyldte membran, der omgives?
- Økologisk landbrug er i gang med mainstream, men ikke som du tror det er
- Et nyt nanomateriale giver håb om bedre opdagelse og behandling af brystkræft


