Hvordan skiftes en reversibel reaktion ved tilsætning af stof?
le Chateliers princip
Dette princip siger, at hvis der anvendes en ændring af betingelsen på et system i ligevægt, vil systemet skifte i en retning, der lindrer stresset. Sådan gælder det at tilføje et stof:
1. Tilføjelse af en reaktant:
* skift: Reaktionen skifter til højre (mod produktsiden) for at forbruge den tilsatte reaktant. Dette skyldes, at systemet ønsker at reducere koncentrationen af den tilsatte reaktant.
Eksempel: Overvej reaktionen:
N₂ (G) + 3H₂ (G) ⇌ 2NH₃ (G)
Hvis vi tilføjer mere nitrogen (N₂), skifter ligevægten til højre for at producere mere ammoniak (NH₃) og forbruge det tilsatte nitrogen.
2. Tilføjelse af et produkt:
* skift: Reaktionen skifter til venstre (mod reaktantsiden) for at forbruge det tilsatte produkt. Systemet sigter mod at reducere koncentrationen af det tilføjede produkt.
Eksempel: I den samme ammoniakreaktion, hvis vi tilsætter mere ammoniak (NH₃), vil ligevægten skifte til venstre for at danne mere nitrogen (N₂) og brint (H₂) og forbruge den tilsatte ammoniak.
Vigtige overvejelser:
* fase: Tilsætningen af et stof påvirker kun ligevægten, hvis det er i den samme fase som reaktanter og produkter. Tilføjelse af et fast stof til en flydende fase-reaktion vil ikke væsentligt skifte ligevægt.
* støkiometri: Omfanget af skiftet afhænger af reaktionens støkiometri. Hvis reaktionen involverer mere mol af et bestemt stof, tilføjer det, at stoffet vil have en større indflydelse på ligevægtsskiftet.
Kortfattet
Tilsætning af et stof til en reversibel reaktion vil få ligevægten til at skifte i en retning, der reducerer koncentrationen af det tilsatte stof. Dette er et grundlæggende princip, der bruges til at forstå og forudsige, hvordan kemiske reaktioner reagerer på ændringer i deres miljø.
 Varme artikler
Varme artikler
-
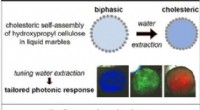 Selvsamling af responsive fotoniske biobaserede materialer i flydende kuglerKredit:Wiley En overflade viser strukturelle farver, når lys reflekteres af små, regulære strukturelle elementer i et gennemsigtigt materiale. Forskere har nu udviklet en metode til at lave strukt
Selvsamling af responsive fotoniske biobaserede materialer i flydende kuglerKredit:Wiley En overflade viser strukturelle farver, når lys reflekteres af små, regulære strukturelle elementer i et gennemsigtigt materiale. Forskere har nu udviklet en metode til at lave strukt -
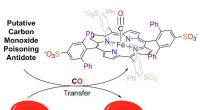 Lås op for en kur mod kulilteforgiftningEn voluminøs, vandopløselig jern-porphyrinforbindelse er blevet fremstillet, som binder CO, sekvestrerer CO fra COHb og redder CO-forgiftede røde blodlegemer. Som sådan kan det tjene som grundlag for
Lås op for en kur mod kulilteforgiftningEn voluminøs, vandopløselig jern-porphyrinforbindelse er blevet fremstillet, som binder CO, sekvestrerer CO fra COHb og redder CO-forgiftede røde blodlegemer. Som sådan kan det tjene som grundlag for -
 Alsidige kemoproteomiske prober til aktivitetsbaseret proteinprofileringNy forskning fra Megan Matthews laboratorium beskriver en alsidig metode til kortlægning af hundredvis af forskellige enzymsteder og proteinfunktioner. Disse nye resultater gør det muligt at profilere
Alsidige kemoproteomiske prober til aktivitetsbaseret proteinprofileringNy forskning fra Megan Matthews laboratorium beskriver en alsidig metode til kortlægning af hundredvis af forskellige enzymsteder og proteinfunktioner. Disse nye resultater gør det muligt at profilere -
 Kemikere skaber ny diagnostisk metode til vanskelige klimaforholdKredit:CC0 Public Domain Forskere fra SCAMT Laboratory of ITMO University udviklede en metode til at påvise viralt RNA uden specielt udstyr. Sensoren er baseret på en polymerisationsreaktion:hvis
Kemikere skaber ny diagnostisk metode til vanskelige klimaforholdKredit:CC0 Public Domain Forskere fra SCAMT Laboratory of ITMO University udviklede en metode til at påvise viralt RNA uden specielt udstyr. Sensoren er baseret på en polymerisationsreaktion:hvis
- Hvorfor har kviksølv en ikke -kortlagt overflade?
- VII, MCM, XL:Romertal gjort forståelige
- Chipbaseret optisk sensor registrerer kræftbiomarkør i urinen
- Meget højenergi gammastråleudsendelse fra en radiogalakse
- Hvordan ændrede Rutherfords fund Thomsons Plum Pudding -model?
- Hvad er IUPAC -nomenklaturen af H2CO3?


