Hvis der er 3 mol brint 6 ilt og 9 helium i et 10 L -kar ved 27 DEGC, vil den samlede trykgasblanding være?
1. Konverter temperatur til Kelvin
* T (k) =t (° C) + 273.15
* T (k) =27 ° C + 273,15 =300,15 K
2. Beregn total mol gas
* Samlet mol =mol brint + mol ilt + mol helium
* Samlede mol =3 + 6 + 9 =18 mol
3. Brug den ideelle gaslov
* PV =NRT
* P =pres (hvad vi vil finde)
* V =volumen (10 l)
* n =antal mol (18 mol)
* R =ideel gaskonstant (0,0821 l · atm/mol · k)
* T =temperatur (300,15 K)
4. Løs for tryk
* P =(nrt) / v
* P =(18 mol * 0,0821 L · ATM / mol · K * 300,15 K) / 10 L
* P ≈ 44,5 atm
Derfor er det samlede tryk på gasblandingen i fartøjet ca. 44,5 atmosfærer.
Sidste artikelHvor mange CM er der i 1 nm?
Næste artikelI fotosyntesen, hvor frigøres ilt og CO2 ind på anlægget?
 Varme artikler
Varme artikler
-
 Når man ændrer et atom, bliver molekyler bedreKredit:pexels/CC0 Udvikling og forbedring af lægemidler spiller den centrale rolle i den igangværende kamp mod sygdomme hos mennesker. Organisk syntese er det felt, der muliggør disse udviklinger,
Når man ændrer et atom, bliver molekyler bedreKredit:pexels/CC0 Udvikling og forbedring af lægemidler spiller den centrale rolle i den igangværende kamp mod sygdomme hos mennesker. Organisk syntese er det felt, der muliggør disse udviklinger, -
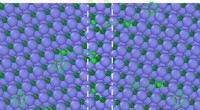 Forståelse af keramiske materialer mørtel kan afsløre måder at forbedre dem påSiliciumcarbid efter bestråling, hvori løse kulstofatomer (grønne) bevæger sig mod grænsen (stiplet linje) mellem korn af den krystallinske keramik. Kredit:Hongliang Zhang Når de fleste tænker på
Forståelse af keramiske materialer mørtel kan afsløre måder at forbedre dem påSiliciumcarbid efter bestråling, hvori løse kulstofatomer (grønne) bevæger sig mod grænsen (stiplet linje) mellem korn af den krystallinske keramik. Kredit:Hongliang Zhang Når de fleste tænker på -
 Fysikere forklarer, hvordan store sfæriske vira dannesSiyu Li (til venstre) er kandidatstuderende i laboratoriet hos Roya Zandi, en professor i fysik ved UC Riverside. De ses her holde forskellige icosahedral strukturer. Kredit:I. Pittalwala, UC Riversid
Fysikere forklarer, hvordan store sfæriske vira dannesSiyu Li (til venstre) er kandidatstuderende i laboratoriet hos Roya Zandi, en professor i fysik ved UC Riverside. De ses her holde forskellige icosahedral strukturer. Kredit:I. Pittalwala, UC Riversid -
 Kemikere opdager ny reaktivitet af anstrengte molekylerMünster-teamet bruger denne laboratorieopsætning til at udføre fotocykloaddition. Kredit:University of Münster - Roman Kleinmans I syntetisk organisk kemi er såkaldte cycloadditioner en særlig vigt
Kemikere opdager ny reaktivitet af anstrengte molekylerMünster-teamet bruger denne laboratorieopsætning til at udføre fotocykloaddition. Kredit:University of Münster - Roman Kleinmans I syntetisk organisk kemi er såkaldte cycloadditioner en særlig vigt
- Egenskaber for 1045 Stål
- Nøjagtig selvevaluering:Hvordan sociale omgivelser påvirker denne evne hos børn
- Månens guldfeber kan skabe konflikt på jorden, hvis vi ikke handler nu - ny forskning
- Brug af brandstyring til at se, hvordan tikker... tikker
- Hvilket stof smelter den hurtigste vandjuice eller mælk?
- En køreplan for grafen


