Når man ændrer et atom, bliver molekyler bedre

Kredit:pexels/CC0
Udvikling og forbedring af lægemidler spiller den centrale rolle i den igangværende kamp mod sygdomme hos mennesker. Organisk syntese er det felt, der muliggør disse udviklinger, da det tilbyder værktøjskassen til at diversificere kemiske strukturer. Gruppen af Nuno Maulide, for nylig kåret til Årets videnskabsmand 2018 i Østrig, i samarbejde med gruppen af Harald Sitte, har nu rapporteret om en let metode til udskiftning af brint med fluor i vigtige lægemiddelmolekyler. Denne nye opdagelse gør det muligt at finjustere eksisterende (og potentielle nye) lægemidler for at give dem forbedrede farmakologiske egenskaber. Resultaterne er for nylig blevet offentliggjort i det anerkendte tidsskrift Naturkemi .
Langt størstedelen af de lægemidler, der anvendes til behandling af menneskelige sygdomme, er af organisk karakter, betyder, at den aktive komponent er et molekyle (eller en kombination af flere molekyler), der består af kulstof- og brintatomer. Denne egenskab deles med alt levende stof, som proteiner, sukkerarter, fedtstoffer og DNA er også baseret på sådanne kulbrinteskeletter, kun adskiller sig efter arrangement og deres substitution med en relativt lille mængde andre mulige grundstoffer (hovedsageligt oxygen, nitrogen, svovl og fosfor). "Vores kroppe er intet andet end en stor samling af milliarder af kulstoffremstillet, eller med andre ord, organiske molekyler", siger Nuno Maulide, for nylig kåret til Årets videnskabsmand 2018 i Østrig og professor ved Wiens Universitet. På grund af denne lighed, organiske lægemidler er ideelle til at interagere med den menneskelige krop, for eksempel ved at binde sig til receptorer og derved udløse eller hæmme en ønsket eller uønsket funktion.
At finde den nøgle, der passer bedst til låsen
Designet af et farmaceutisk molekyle rettet mod en specifik interaktion med en receptiv struktur er ofte konceptualiseret ved analogien af en lås og en nøgle. "Receptoren (for eksempel et enzym) har en unik struktur (lås) og kræver derfor en unik struktur (nøgle) at interagere med. På grund af behovet for en nøjagtig tilpasning, den strukturelle integritet af den farmaceutiske forbindelse er nøglen (ordspil beregnet!) for at sikre dens gavnlige bioaktivitet", forklarer Harald Sitte, Professor ved det medicinske universitet i Wien og medforfatter til undersøgelsen.
Kredit:Universitetet i Wien
Forsøger at undslippe oprydningen
Imidlertid, ligesom næringsstoffer omsættes af kroppen, lægemidler, der kommer ind i kroppen (består af de samme væsentlige bestanddele, kulstof, brint, …) nedbrydes også af de samme enzymer, som metaboliserer og eliminerer vores fødevarebestanddele. "Denne type oprydningsmaskineri er afgørende for vores krop for at kunne beskytte sig selv; molekyler, der er uønskede og kan have negative virkninger, skal elimineres hurtigt. Desværre, sådanne maskiner er ofte vilkårlige, og lægemidler vil også blive metaboliseret, så snart de kommer i kontakt med kroppen", forklarer Christopher Teskey, PostDoc i Maulide-gruppen og fælles førsteforfatter af undersøgelsen. Dette kan ændre strukturen af lægemidler og derfor også fjerne deres gavnlige egenskaber. "Store dele af denne nedbrydning sker netop ved krydset mellem kulstof- og brintatomer (CH-bindinger), der kan brydes eller ændres for at danne nye forbindelser, der lettere kan fjernes fra kroppen ved udskillelse. C-H-bindinger er i sagens natur ret svage bindinger, hvilket betyder, at oxidation let kan finde sted", forklarer Pauline Adler, tidligere PostDoc i Maulide-gruppen og undersøgelsens anden fælles førsteforfatter. "Det er i sidste ende et kapløb om at undslippe oprydning! Jo længere et gavnligt lægemiddel kan undslippe denne kat-og-mus-jagt med metabolisme-enzymer, jo længere dens gavnlige virkning kan mærkes i kroppen", joker Maulide.
En smart løsning:at bytte H med F kan være en 2-i-1
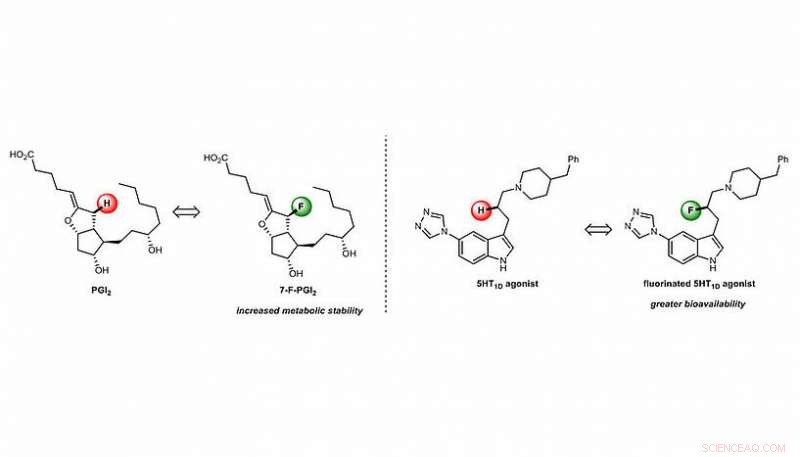
Det er derfor indlysende, at hvis de strukturelle svage punkter af lægemiddelmolekyler kunne elimineres eller afbødes, deres metaboliske stabilitet kunne øges betydeligt. Kemikere har for nogle år siden fundet ud af, at den strategiske udskiftning af særligt svage C-H-bindinger med meget stærkere C-F-bindinger kan være en meget givende tilgang i denne retning. Mens brint og fluor er tydeligt forskellige i nogle henseender, deres størrelser er sammenlignelige, og udskiftningen af H med F kan derfor ofte antages kun at have minimal effekt på strukturen af nøglen (farmaceutisk). "Endnu mere, på grund af disse forskellige elektroniske egenskaber, et strategisk placeret fluoratom kan potentielt etablere yderligere interaktioner med sit mål (lås), derved øge den ønskede aktivitet", forklarer Maulide. "I øvrigt, introduktion af fluor i et lægemiddelmolekyle kan ændre dets egenskaber på en sådan måde, at det lettere kan absorberes af kroppen (øget biotilgængelighed), igen at øge mængden af lægemiddel, der kan finde og interagere med dets receptor. Det kan virkelig være en 2-i-1 situation!", udtaler Daniel Kaiser, tidligere ph.d. elev af Maulide-gruppen og medforfatter til undersøgelsen (figur 1).
Kredit:Universitetet i Wien
Udfordringen med at erstatte H med F:hvis bare du kunne bruge tandpasta
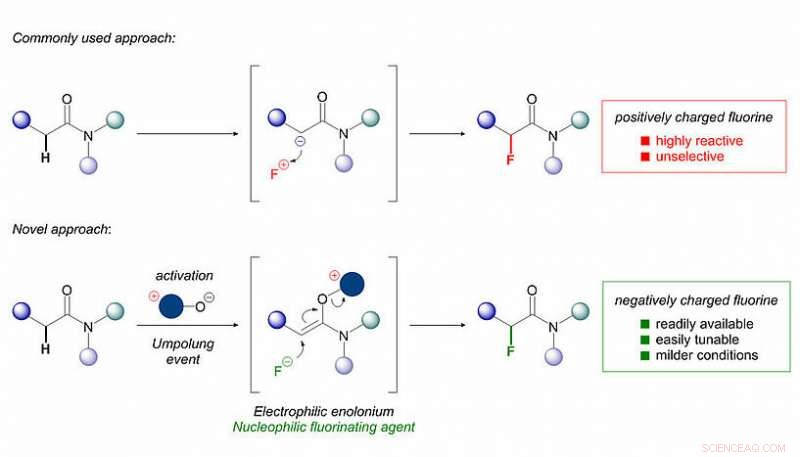
Mens introduktionen af fluor kan have denne brede vifte af gavnlige virkninger på et lægemiddel, dens placering på organiske molekyler er ofte langt fra triviel. De mest almindelige metoder til fluorering involverer meget reaktive, ætsende og nogle gange giftige reagenser. Disse reagenser er baseret på positivt ladede fluoratomer (F+), som er langt dyrere og vanskeligere at håndtere end deres almindelige og billige negativt ladede (F–) fluor-modstykker (selve fluoranionen er almindeligt kendt, for eksempel, som en bestanddel af tandpasta).
En simpel løsning og den første demonstration
Forskergruppen af Prof. Nuno Maulide (Institutet for Organisk Kemi, Universitetet i Wien) har nu opdaget en let og selektiv metode til introduktion af fluoratomer i organiske molekyler ved hjælp af den bredt tilgængelige fluoridanion (F–). "De fleste kemikere har søgt at introducere fluor ved at bruge negativt polariserede organiske molekyler, der kan reagere med et F+-reagens. Vi gjorde simpelthen det modsatte:Skift polaritet på det organiske molekyle, så vi kan bruge det samme fluor, som du har i tandpasta!", begejstret Maulide. Vigtigt, denne tilgang anvender billige udgangsmaterialer, er operativt simpelt og leverer høje udbytter af produkterne på kort tid.
Credit:University of Vienna
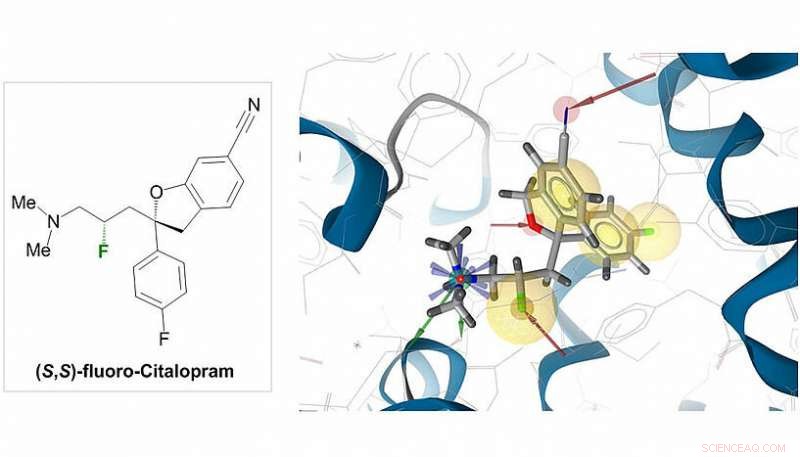
In the published work, several fluorinated analogues of common bioactive agents were easily synthesised, most prominently fluoro-Citalopram. "The parent molecule Citalopram is a blockbuster antidepressant used in the treatment of clinical depression. It interacts with the serotonin transporter (SERT) and raises the synaptic concentration of serotonin to alleviate the depressive symptoms", explains Sitte. In collaboration with the group of Prof. Harald Sitte (MedUni Vienna), Prof. Maulide and his team were able to establish that the activity of Citalopram is retained upon insertion of a fluorine atom. Væsentligt, while the activity is retained (despite the structural change), other pharmacological factors, such as metabolic stability and bioavailability, are expected to improve as a consequence of fluorination. The teams therefore believe that fluoro-Citalopram could present a viable alternative to the non-fluorinated analogue.
Chemistry opens the door
"Having a method to exchange H with F under such simple conditions is but the beginning. We can now imagine doing this exchange in a range of other pharmaceuticals and study the properties of the resulting, new analogues. Since the exchange of H with F is also a technique that can be of relevance to the materials industry, you can understand why we are excited about this work", explains Maulide. "This is a great example of the power of Chemistry:because we are able to manipulate the structure of matter at a molecular level with atomic precision, we can open doors that would otherwise remain closed to the imagination", closes Maulide.
 Varme artikler
Varme artikler
-
 En ny metode til installation af svovl i komplekse molekylerForskere, der arbejder i laboratoriet i Ben Shen, Ph.d., hos Scripps Research, Florida har fundet en ny familie af svovlinstallerende enzymer ved at udvinde bakteriernes genomer i deres samling af mik
En ny metode til installation af svovl i komplekse molekylerForskere, der arbejder i laboratoriet i Ben Shen, Ph.d., hos Scripps Research, Florida har fundet en ny familie af svovlinstallerende enzymer ved at udvinde bakteriernes genomer i deres samling af mik -
 Olivenmøllens spildevand omdannet:Fra forurenende stof til biogødning, biobrændstofKredit:American Chemical Society Olivenolie har længe været et populært køkkenprodukt. Men produktionen af olien skaber en stor strøm af spildevand, der kan forurene vandveje, reducere jordens f
Olivenmøllens spildevand omdannet:Fra forurenende stof til biogødning, biobrændstofKredit:American Chemical Society Olivenolie har længe været et populært køkkenprodukt. Men produktionen af olien skaber en stor strøm af spildevand, der kan forurene vandveje, reducere jordens f -
 Forskere syntetiserer nye kunstige molekyler, der efterligner et cellemembranproteinEn usymmetrisk molekylær struktur muliggør orienteret indsættelse af den syntetiske amfifil til et dobbeltlag ved tilsætning til en præformet membran. Kompleksation med en ligand tilskynder iontranspo
Forskere syntetiserer nye kunstige molekyler, der efterligner et cellemembranproteinEn usymmetrisk molekylær struktur muliggør orienteret indsættelse af den syntetiske amfifil til et dobbeltlag ved tilsætning til en præformet membran. Kompleksation med en ligand tilskynder iontranspo -
 Udnyttelse af reversibel opløselighed giver mulighed for direkte, optisk mønster af hidtil uset sm…Tynde film af halvledende polymerer blev fremstillet med en overflade-initieret vækst, resulterer i en unik molekylær organisation. Polymerkæder voksede fra overfladen og foldede derefter for at danne
Udnyttelse af reversibel opløselighed giver mulighed for direkte, optisk mønster af hidtil uset sm…Tynde film af halvledende polymerer blev fremstillet med en overflade-initieret vækst, resulterer i en unik molekylær organisation. Polymerkæder voksede fra overfladen og foldede derefter for at danne
- Litteraturkvalitet knyttet til fremmedsprogsevne hos unge
- Seymour Benzer
- Smukke mennesker vinder ikke altid på arbejdspladsen
- Forskere får første kig på årsagen til slow -motion jordskælv
- Du smører tro det:Pålæg med lavt kalorieindhold, hovedsagelig lavet af vand
- Rensning af luften:En reduktionsbaseret løsning på nitrogenforurening med en ny katalysator


