Er der en reaktion, hvis der ikke dannes nogen bundfald eller gas i en ionisk ligning?
* Dannelse af en svag elektrolyt: Reaktionen producerer muligvis en svag elektrolyt, som er en forbindelse, der kun delvist er ioniseret i opløsningen. Selvom dette ikke fører til synlige ændringer som nedbør eller gasudvikling, forekommer reaktionen stadig.
* varmeændring: En reaktion kan involvere en betydelig varmeændring (enten frigørelse eller absorberende varme), hvilket indikerer en kemisk ændring, selv uden synlige produkter. Dette er ofte forbundet med reaktioner som neutralisering (syre-base-reaktioner), hvor varmeændringen er ganske mærkbar.
* farveændring: Nogle reaktioner resulterer i en mærkbar farveændring, hvilket indikerer en kemisk ændring. Dette kan ske på grund af dannelsen af en farvet kompleks ion eller en ændring i oxidationstilstanden for en metalion.
* Ændring i pH: En reaktion kan ændre pH i opløsningen, hvilket indikerer en ændring i koncentrationen af H+ eller OH-ioner. Dette observeres ofte i syre-base-reaktioner.
* redoxreaktioner: Redoxreaktioner (involverende elektronoverførsel) kan forekomme uden dannelse af bundfald eller gasser. Disse reaktioner kan involvere ændringer i oxidationstilstande af elementer, selvom de visuelt ikke påvises.
Eksempel:
Overvej reaktionen mellem en stærk syre (som HCI) og en svag base (som ammoniak, NH3):
`` `
HCL (aq) + NH3 (aq) -> NH4CL (aq)
`` `
* Ingen bundfaldsformularer.
* Ingen gas udvikles.
* Reaktionen forekommer imidlertid, og opløsningen bliver varmere (varme frigøres).
Sammenfattende betyder fraværet af et bundfald eller gasudvikling ikke altid, at der ikke er nogen reaktion. Du skal overveje andre indikatorer som varmeændring, farveændring, pH -ændring og redoxreaktioner for at bestemme, om en kemisk reaktion har fundet sted.
Sidste artikelHvor er elementer med det samme antal valenselektroner?
Næste artikelHvor mange fosforatomer er der i trihydrid PH3?
 Varme artikler
Varme artikler
-
 En klogere, sikrere måde at bekæmpe korrosion:Forskning viser, at ny korrosionsinhibitor er 10 gan…Testresultater, der viser områder på 1 mm (Intelli-ion) vs. 10 mm (kontrol) krybning i prøver. Kredit:Hexigone Ltd Uafhængig forskning har vist, at en sikrere, smartere korrosionsinhibitor kan bes
En klogere, sikrere måde at bekæmpe korrosion:Forskning viser, at ny korrosionsinhibitor er 10 gan…Testresultater, der viser områder på 1 mm (Intelli-ion) vs. 10 mm (kontrol) krybning i prøver. Kredit:Hexigone Ltd Uafhængig forskning har vist, at en sikrere, smartere korrosionsinhibitor kan bes -
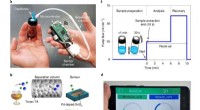 Bærbar smartphone-tilføjelse kan måle methanol i alkoholholdige drikkevarerAnalysator design. en, Den håndholdte analysator under måling. b, En skematisk oversigt over detekteringskonceptet. c, Prøveudtagning og analyseprocedure. d, Den skræddersyede app til at visualisere r
Bærbar smartphone-tilføjelse kan måle methanol i alkoholholdige drikkevarerAnalysator design. en, Den håndholdte analysator under måling. b, En skematisk oversigt over detekteringskonceptet. c, Prøveudtagning og analyseprocedure. d, Den skræddersyede app til at visualisere r -
 Pulverisering af elektronisk affald er grønt, ren - og koldPrintplader fra elektronik, som computermus, kan knuses til nanodstøv af en kryomølle, ifølge forskere ved Rice University og Indian Institute of Science. Støvet kan derefter let adskilles i dets komp
Pulverisering af elektronisk affald er grønt, ren - og koldPrintplader fra elektronik, som computermus, kan knuses til nanodstøv af en kryomølle, ifølge forskere ved Rice University og Indian Institute of Science. Støvet kan derefter let adskilles i dets komp -
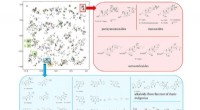 SMART:Ansigtsgenkendelse for molekylære strukturerSMART klyngekortet baseret på træningsresultat på 2, 054 HSQC-spektre over 83, 000 gentagelser, med indsatte bokse, der repræsenterer forskellige sammensatte klasser diskuteret i teksten. Kredit:Unive
SMART:Ansigtsgenkendelse for molekylære strukturerSMART klyngekortet baseret på træningsresultat på 2, 054 HSQC-spektre over 83, 000 gentagelser, med indsatte bokse, der repræsenterer forskellige sammensatte klasser diskuteret i teksten. Kredit:Unive
- Bornitrid er en lovende vej til praktiske grafenenheder
- Modellen simulerer risikoen for oversvømmelser i byer med et øje for retfærdighed
- Miljøpåvirkning af flaskevand op til 3, 500 gange højere end ledningsvand
- Ny tilgang kan spare op til 95 procent af den energi, der bruges til rørledninger
- Fej træaske fra pejs til have
- Lokale nedlukninger kan føre til civil uorden, og her er hvorfor


