Hvad opdagede Niels Bohr om, hvor elektroner kan findes?
* Elektroner kredserer kernen i specifikke, kvantiserede energiniveauer. Dette betyder, at elektroner kun kan besætte specifikke energiniveauer, ikke nogen tilfældig position.
* Hvert energiniveau har en fast afstand fra kernen. Jo længere en elektron er fra kernen, jo højere er det energiniveau.
* Elektroner kan hoppe mellem energiniveauet ved at absorbere eller udsende fotoner af specifikke energier. Dette forklarer de karakteristiske spektrale linjer, der udsendes af atomer.
Mens Bohr -modellen var en stor fremgang i forståelsen af atomstruktur, har den nogle begrænsninger. Det beskriver ikke nøjagtigt opførsel af elektroner i multi-elektronatomer og undlader at forklare de finere detaljer om atomspektre.
Senere udviklinger, som kvantemekanik, gav en mere nøjagtig forståelse af elektronadfærd, der beskriver den som en bølgepartikel-dualitet. Dette betyder, at elektroner ikke kan betragtes som kredsende kernen som planeter omkring en sol, men snarere findes i en sky af sandsynlighed kaldte en orbital . Denne sky repræsenterer sandsynligheden for at finde et elektron i en bestemt region af rummet.
Så selvom Bohrs model ikke var helt nøjagtig, lagde den grundlaget for vores nuværende forståelse af, hvordan elektroner er arrangeret i atomer, og understregede, at de besætter specifikke energiniveauer og kan skifte mellem dem.
 Varme artikler
Varme artikler
-
 Video:Kemien ved madlavningKredit:The American Chemical Society Voldsomme køkkengadgets som langsomme komfurer og trykkogere fylder meget. Mange mennesker spekulerer måske på, om det er umagen værd at eje så mange glorifice
Video:Kemien ved madlavningKredit:The American Chemical Society Voldsomme køkkengadgets som langsomme komfurer og trykkogere fylder meget. Mange mennesker spekulerer måske på, om det er umagen værd at eje så mange glorifice -
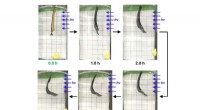 Ny molekylær muskel reagerer på synligt lysPolymeren blev fastgjort til en slip af sort elektrisk tape. Udsat for blåt lys, den kunstige molekylære muskel flyttede en vægt på 20 milligram flere centimeter fra sin startposition. Kredit:Barnes l
Ny molekylær muskel reagerer på synligt lysPolymeren blev fastgjort til en slip af sort elektrisk tape. Udsat for blåt lys, den kunstige molekylære muskel flyttede en vægt på 20 milligram flere centimeter fra sin startposition. Kredit:Barnes l -
 Slidte dæk kunne genbruges i nye asfaltvejeBelastningstest:Siden oktober 2020, gummiasfalt er blevet lagt i et trafikeret kryds i Zürich til testformål. Kredit:Gian Vaitl Schweiziske bilister slider utallige dæk. I stedet for at forbrænde
Slidte dæk kunne genbruges i nye asfaltvejeBelastningstest:Siden oktober 2020, gummiasfalt er blevet lagt i et trafikeret kryds i Zürich til testformål. Kredit:Gian Vaitl Schweiziske bilister slider utallige dæk. I stedet for at forbrænde -
 En milepæl inden for ultrahurtig gelfremstilling fra ukonventionelle selvhelbredende ædelmetalgele…Ultrahurtig gelfremstilling. Kredit:Ran DU et al. Sage 2020. Elektrokatalyse er i vid udstrækning involveret i mange vigtige energirelaterede processer, såsom oxygenreduktionsreaktionen (ORR) for
En milepæl inden for ultrahurtig gelfremstilling fra ukonventionelle selvhelbredende ædelmetalgele…Ultrahurtig gelfremstilling. Kredit:Ran DU et al. Sage 2020. Elektrokatalyse er i vid udstrækning involveret i mange vigtige energirelaterede processer, såsom oxygenreduktionsreaktionen (ORR) for
- Nytænkning af kosmologi:Universets ekspansion er muligvis ikke ensartet (Opdatering)
- Fireweed:The Pink Pioneer
- Britiske virksomheders giganter underskriver pagt for at reducere plastikaffald
- Kommercielle amerikanske rumskib timer fra forsøg på månelanding
- Vil Disneys streamingtjeneste brøle - eller knirke?
- Giver sociale medier næring til politisk polarisering?


