Hvorfor kobber i gruppe 1 i den periodiske tabel?
Her er hvorfor:
* Elektronkonfiguration: Kobber har en elektronkonfiguration af [AR] 3d¹⁰ 4S¹. Gruppe 1-elementer (alkalimetaller) har kun en valenselektron i deres yderste S-Orbital. Kobberkonfiguration viser, at den har en valenselektron i 4S -orbitalen, men også en fuld D -orbital, som ikke er typisk for gruppe 1 -elementer.
* Kemiske egenskaber: Kobberens kemiske egenskaber er meget forskellige fra alkalimetaller. Kobberformer farvede forbindelser, har et relativt højt smeltepunkt og er mindre reaktiv end alkalimetaller.
* Periodiske tendenser: Kobberens position i den periodiske tabel stemmer overens med dens egenskaber, idet det er et overgangsmetal med en delvist fyldt D-orbital.
Fortæl mig, hvis du har andre spørgsmål om den periodiske tabel!
 Varme artikler
Varme artikler
-
 Fra krystaller til briller:en ny samlet teori for varmetransportVarme strømmer fra varmere til køligere områder af amorft silicium. Kredit:Leyla Isaeva Teoretiske fysikere fra SISSA og University of California i Davis har udviklet en ny tilgang til varmetransp
Fra krystaller til briller:en ny samlet teori for varmetransportVarme strømmer fra varmere til køligere områder af amorft silicium. Kredit:Leyla Isaeva Teoretiske fysikere fra SISSA og University of California i Davis har udviklet en ny tilgang til varmetransp -
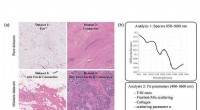 Fund bekræfter billeddannelsesteknikkernes evne til at skelne sundt væv efter neoadjuvant kemotera…95% bindevæv (datasæt 2), en blanding af fedt og bindevæv (datasæt 3) eller en blanding af tumorceller og bindevæv (datasæt 4). Kredit:Lisanne L. de Boer, Marie-Jeanne T.F.D. Vrancken Peeters, og F. v
Fund bekræfter billeddannelsesteknikkernes evne til at skelne sundt væv efter neoadjuvant kemotera…95% bindevæv (datasæt 2), en blanding af fedt og bindevæv (datasæt 3) eller en blanding af tumorceller og bindevæv (datasæt 4). Kredit:Lisanne L. de Boer, Marie-Jeanne T.F.D. Vrancken Peeters, og F. v -
 Gør mere plast genanvendeligtDIMOP-projektet har til formål at udvikle digitale værktøjer til nemt at bestemme og forbedre genanvendeligheden af plastprodukter, for eksempel, ved at reducere antallet af materialekomponenter. Kr
Gør mere plast genanvendeligtDIMOP-projektet har til formål at udvikle digitale værktøjer til nemt at bestemme og forbedre genanvendeligheden af plastprodukter, for eksempel, ved at reducere antallet af materialekomponenter. Kr -
 Smedning af molekylære bindinger med grønt lysKredit:Queensland University of Technology (QUT) QUT-forskere har skabt et nyt molekylært koblingsværktøj, der anvender både grønt lys og pH-triggere, der har potentiale til brug i applikationer s
Smedning af molekylære bindinger med grønt lysKredit:Queensland University of Technology (QUT) QUT-forskere har skabt et nyt molekylært koblingsværktøj, der anvender både grønt lys og pH-triggere, der har potentiale til brug i applikationer s
- Undersøge bæredygtige agrometeorologiske tjenester og resultater for landbruget i Laos
- Elsker du din bil? Det kan være dyrt at blive for knyttet
- Fysiske egenskaber ved Styrofoam
- Maskinlæring leder efter nyttige data i amerikanske tordenvejrsrapporter
- Big Bang-teorien, hvordan virker
- Vedvarende politiindsats forklarer flere arrestationer for våbenmord


