Hvad hedder Compound Cu2So6?
* kobber (CU) kan danne flere oxidationstilstande. De mest almindelige er cu⁺ (kobber (i)) og cu²⁺ (kobber (II)).
* sulfat (SO₄) ²⁻ har en fast ladning. Sulfationer har altid en afgift på -2.
For at danne en neutral forbindelse skal kobberionens og sulfationens ladninger og sulfationen balancere. Lad os analysere mulighederne:
* hvis kobber (i) er involveret: To Cu⁺ioner (total ladning +2) har brug for en so₄²⁻ion (ladning -2) for at balancere. Dette ville danne forbindelsen cu₂so₄ , som er kendt som kobber (i) sulfat .
* Hvis kobber (II) er involveret: En cu²⁺ion (ladning +2) har brug for en so₄²⁻ion (ladning -2) for at balancere. Dette ville danne forbindelsen cuso₄ , som er kendt som kobber (II) sulfat .
Derfor findes cu₂so ikke som en stabil forbindelse.
Sidste artikelHvorfor kobber i gruppe 1 i den periodiske tabel?
Næste artikelHvad ville der ske, hvis kobbersulfat fordampede?
 Varme artikler
Varme artikler
-
 Forskere udvikler ny kemi for at gøre smarte stoffer smartereKredit:Georgia State University En metode til at aktivere målrettede lægemidler, eller smarte stoffer, kun på det valgte handlingssted, en tilgang, der forbedrer lægemidlets terapeutiske virkning
Forskere udvikler ny kemi for at gøre smarte stoffer smartereKredit:Georgia State University En metode til at aktivere målrettede lægemidler, eller smarte stoffer, kun på det valgte handlingssted, en tilgang, der forbedrer lægemidlets terapeutiske virkning -
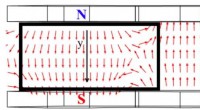 Magnetfelters indflydelse på tyndfilmstrukturerVisualisering af et magnetfelt mellem permanente magneter ved placeringen af substratet til aflejring af NiFe/IrMn film tyndfilmstruktur. Kredit:Valeria Rodionova Et team af forskere fra Immanue
Magnetfelters indflydelse på tyndfilmstrukturerVisualisering af et magnetfelt mellem permanente magneter ved placeringen af substratet til aflejring af NiFe/IrMn film tyndfilmstruktur. Kredit:Valeria Rodionova Et team af forskere fra Immanue -
 Retsmedicinsk forskning viser, at tekstilfibre kan overføres mellem tøj uden kontaktKredit:CC0 Public Domain Banebrydende retsmedicinsk forskning ved Northumbria University, Newcastle, har for første gang afsløret, at tekstilfibre kan, under visse omstændigheder, flyttes mellem t
Retsmedicinsk forskning viser, at tekstilfibre kan overføres mellem tøj uden kontaktKredit:CC0 Public Domain Banebrydende retsmedicinsk forskning ved Northumbria University, Newcastle, har for første gang afsløret, at tekstilfibre kan, under visse omstændigheder, flyttes mellem t -
 Agroindustrielt affald kan bruges som materiale til boliger og infrastrukturEt projekt med fokus på brugen af ikke-giftige materialer og bæredygtig produktion har allerede skabt fibercementpaneler og biomassespånplader til flere formål (foto:Eduardo César / Pesquisa FAPESP
Agroindustrielt affald kan bruges som materiale til boliger og infrastrukturEt projekt med fokus på brugen af ikke-giftige materialer og bæredygtig produktion har allerede skabt fibercementpaneler og biomassespånplader til flere formål (foto:Eduardo César / Pesquisa FAPESP
- Hvordan adskiller en ideel gas sig fra en ægte gas?
- Hvad er tre nukleotider på overførsel RNA, der er komplementære til messenger -RNA?
- Sukker opløses i vand hurtigere end saltvidenskabsprojekter
- Netflix:En zebra blandt heste
- En forenklet ny proces omdanner træaffald fra landbrug og skovforvaltning til ethanol
- Hurtig påvisning af uranisotoper hjælper med at beskytte nukleare materialer


