Hvilken forbindelse frigiver ioner, når de er i løsninger?
Her er en sammenbrud:
* ioner: Atomer eller molekyler, der har opnået eller mistet elektroner, hvilket giver dem en positiv eller negativ ladning.
* elektrolytter: Stoffer, der kan udføre elektricitet, når de opløses i vand. Denne ledning skyldes bevægelsen af ioner.
Eksempler på elektrolytter:
* salte: Ligesom bordsalt (NaCl), der adskiller sig i natriumioner (Na+) og chloridioner (Cl-) i vand.
* syrer: Ligesom saltsyre (HCI), der adskiller sig i hydrogenioner (H+) og chloridioner (Cl-) i vand.
* baser: Ligesom natriumhydroxid (NaOH), der adskiller sig i natriumioner (Na+) og hydroxidioner (OH-) i vand.
Ikke-elektrolytter er forbindelser, der ikke frigiver ioner, når de opløses i opløsning. Disse stoffer udfører ikke elektricitet.
Eksempler på ikke-elektrolytter:
* sukker: Som glukose (C6H12O6)
* Alkoholer: Som ethanol (C2H5OH)
* De fleste organiske forbindelser: Som fedt og olier
Fortæl mig, hvis du har andre spørgsmål!
Sidste artikelHvorfor er anioner større end det neutrale element, de plejede at være?
Næste artikelHar H2S en BTU -værdi?
 Varme artikler
Varme artikler
-
 Skaber et ikke-giftigt alternativ til farvet røgKredit:imago images / Shotshop Farvet røg bliver i stigende grad brugt som et skueelement i et bredt spektrum af offentlige arrangementer. Imidlertid, de kemikalier, der anvendes til dette formål,
Skaber et ikke-giftigt alternativ til farvet røgKredit:imago images / Shotshop Farvet røg bliver i stigende grad brugt som et skueelement i et bredt spektrum af offentlige arrangementer. Imidlertid, de kemikalier, der anvendes til dette formål, -
 Stress og belastning:Geokemister besvarer grundlæggende spørgsmål om mineralreaktionerArgonne-forskere brugte kohærent røntgendiffraktionsbilleddannelse til at se på stammen inde i en jernnanopartikel, da den oxiderede. Dette billede viser nanopartiklen gradvist oxiderende. Kredit:Argo
Stress og belastning:Geokemister besvarer grundlæggende spørgsmål om mineralreaktionerArgonne-forskere brugte kohærent røntgendiffraktionsbilleddannelse til at se på stammen inde i en jernnanopartikel, da den oxiderede. Dette billede viser nanopartiklen gradvist oxiderende. Kredit:Argo -
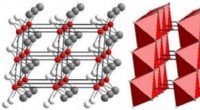 Mineralopdagelse gjort nemmere:Røntgenteknik kaster nyt lys på bittesmå, sjældne krystallerDisse diagrammer viser atomkrystalstrukturen af ognitit. Til venstre, atomer i den krystallinske struktur er repræsenteret i rødt (nikkel), hvid (tellur), og grå (vismut). Til højre, en polyhedral r
Mineralopdagelse gjort nemmere:Røntgenteknik kaster nyt lys på bittesmå, sjældne krystallerDisse diagrammer viser atomkrystalstrukturen af ognitit. Til venstre, atomer i den krystallinske struktur er repræsenteret i rødt (nikkel), hvid (tellur), og grå (vismut). Til højre, en polyhedral r -
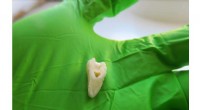 Super stærk, biokompatibelt materiale kan gøre ødelagte fyldninger til fortidenEn laboratorieforsker ordner fyldningen i en prøvetand. Kredit:KTH Kgl. Teknologisk Institut Snart behøver du måske ikke længere bekymre dig om, hvor længe dine tandreparationer vil vare. Et nyt d
Super stærk, biokompatibelt materiale kan gøre ødelagte fyldninger til fortidenEn laboratorieforsker ordner fyldningen i en prøvetand. Kredit:KTH Kgl. Teknologisk Institut Snart behøver du måske ikke længere bekymre dig om, hvor længe dine tandreparationer vil vare. Et nyt d
- Astronomer bekræfter kollision mellem to Mælkevejen satellitgalakser
- Nedstråling af jordens energi fra rummet
- Er det mexicanske gen stærkere end filippinsk gen?
- Kunne handel med egern have bidraget til Englands middelalderlige spedalskhedsudbrud?
- Er denne erklæring sand eller falsk, en gruppe af forskellige organismer, der bor sammen i bestemte…
- Videodommeren i søgelyset


