Hvad sker der med ioner, efter at saltvand fordamper?
1. Grundlæggende om saltvand
* salt (NaCl): Salt opløses i vand og bryder ned i dets komponentioner:positivt ladede natriumioner (Na+) og negativt ladede chloridioner (Cl-).
* vand (H2O): Vandmolekyler er polære, hvilket betyder, at de har en lidt positiv ende og en lidt negativ ende. Denne polaritet giver dem mulighed for at tiltrække og omringe ionerne og holde dem opløst.
2. Fordampning
* vandmolekyler flugt: Når vand fordamper, får vandmolekylerne nok energi til at bryde fri fra flydende tilstand og blive vanddamp i luften.
* ioner efterladt: Da ionerne (Na+ og Cl-) er meget tungere og har stærkere attraktioner til hinanden end til vandmolekylerne, har de ikke nok energi til at flygte med vanddampen.
3. Resultatet:saltkrystallisation
* Koncentration øges: Når vand fordamper, øges koncentrationen af ioner i det resterende vand.
* krystaldannelse: Til sidst bliver koncentrationen af ioner så høj, at de attraktive kræfter mellem dem overvinder kræfterne, der holder dem i opløsning. Ionerne begynder at komme sammen og danne en regelmæssig, gentagende struktur - en saltkrystall.
Kortfattet: Når saltvand fordamper, slipper vandmolekylerne som damp og efterlader de opløste ioner. Disse ioner samles derefter sammen for at danne faste saltkrystaller.
 Varme artikler
Varme artikler
-
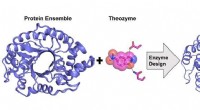 Mutanternes stigning:Ny forskning for at forbedre enzymdesignmetoderBeregningsdesign af et meget aktivt kunstigt enzym fra et proteinstrukturelt ensemble. Kredit:Rojo Rakotoharisoa En gruppe forskere ved University of Ottawa har ledt efter måder at forbedre enzymd
Mutanternes stigning:Ny forskning for at forbedre enzymdesignmetoderBeregningsdesign af et meget aktivt kunstigt enzym fra et proteinstrukturelt ensemble. Kredit:Rojo Rakotoharisoa En gruppe forskere ved University of Ottawa har ledt efter måder at forbedre enzymd -
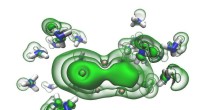 Et forsøg foreslået af en ph.d. elev kan omskrive kemi lærebøgerSolvatiserede elektroner (grønne) i hullerne mellem ammoniakmolekyler (blå og hvide) begynder at smelte sammen til et par, efterhånden som en opløsning bevæger sig mod at blive metallisk. Kredit:Ryan
Et forsøg foreslået af en ph.d. elev kan omskrive kemi lærebøgerSolvatiserede elektroner (grønne) i hullerne mellem ammoniakmolekyler (blå og hvide) begynder at smelte sammen til et par, efterhånden som en opløsning bevæger sig mod at blive metallisk. Kredit:Ryan -
 Team skaber ny ultraletvægt, knusningsbestandige tensegrity-metamaterialerNye tensegrity-metamaterialer fra UCI og Georgia Institute of Technology-forskere anvender isolerede kompressionsløkkeelementer, der udelukkende er forbundet gennem et kontinuerligt netværk af trækele
Team skaber ny ultraletvægt, knusningsbestandige tensegrity-metamaterialerNye tensegrity-metamaterialer fra UCI og Georgia Institute of Technology-forskere anvender isolerede kompressionsløkkeelementer, der udelukkende er forbundet gennem et kontinuerligt netværk af trækele -
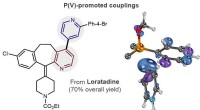 Bevæbning af narkojægere, kemikere designer ny reaktion til lægemiddelopdagelseDet venstre billede er en modifikation af antihistaminlægemidlet loratadin lavet via pyridin-pyridin-koblingsmetoden udviklet af CSU-kemikere. Den fede linje repræsenterer reaktionen, hvis resultat er
Bevæbning af narkojægere, kemikere designer ny reaktion til lægemiddelopdagelseDet venstre billede er en modifikation af antihistaminlægemidlet loratadin lavet via pyridin-pyridin-koblingsmetoden udviklet af CSU-kemikere. Den fede linje repræsenterer reaktionen, hvis resultat er
- Nyt spektrometer hjælper med at identificere alternative katalysatormaterialer til overkommelige br…
- De forskellige slags dyr og planter på Ben Nevis?
- Heterostrukturkrystaller kunne lyse vejen til optiske kredsløb
- Sådan beregnes Force
- Sådan beregner eksperter OL's CO2-fodaftryk:83 flasker vin pr. person
- Hvad forårsager de forskellige farver af nordlys? En ekspert forklarer elektrisk regnbue


