Mutanternes stigning:Ny forskning for at forbedre enzymdesignmetoder
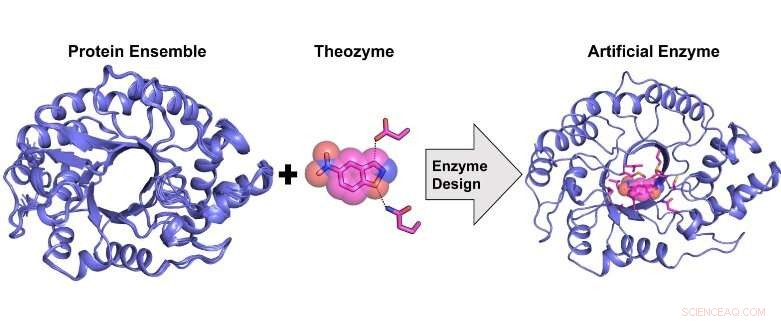
Beregningsdesign af et meget aktivt kunstigt enzym fra et proteinstrukturelt ensemble. Kredit:Rojo Rakotoharisoa
En gruppe forskere ved University of Ottawa har ledt efter måder at forbedre enzymdesignmetoder på og har for nylig offentliggjort deres resultater i Naturkommunikation .
Enzymer bruges i mange industrielle og bioteknologiske anvendelser. Med deres mange gavnlige egenskaber, de er de mest effektive katalysatorer man kender - de har endda magt til at fremskynde kemiske reaktioner mere end en milliard gange. Men da antallet af naturligt forekommende enzymaktiviteter er begrænset, antallet af ansøgninger er også begrænset. Mens det er lykkedes forskere at skabe kunstige enzymer, deres katalytiske effektivitet når ikke det samme niveau som for naturlige enzymer.
Vi talte med seniorforfatter Roberto Chica, Fuld professor i Institut for Kemi og Biomolekylære Videnskaber ved University of Ottawa, for at lære mere om hans fund.
Kan du venligst fortælle os mere om kunstigt designede enzymer?
"I løbet af de sidste 20 år har forskere har med succes designet kunstige enzymer fra bunden til en række forskellige organiske transformationer. Dette blev udført ved hjælp af en procedure kaldet 'beregningsenzymdesign', hvor et katalytisk sted blev beregnet opbygget på et allerede eksisterende proteinstillads uden målkatalytisk aktivitet.
Mens det lykkedes, denne fremgangsmåde har udelukkende givet kunstige enzymer, der udviser katalytiske effektiviteter, der er størrelsesordener lavere end for naturlige enzymer, kræver efterfølgende optimering ved hjælp af det, der kaldes 'rettet evolution' for at forbedre aktiviteten. Directed evolution er en proces, hvor tilfældige mutationer indføres i et protein for at generere et stort bibliotek af mutante enzymer, som derefter screenes for at identificere gavnlige mutationer. Det kræver ofte flere runder med tilfældig mutagenese og screening for at øge aktiviteten betydeligt. "
Hvordan forholder din forskning sig til styret evolution?
"I vores arbejde, vi afslører, hvordan styret evolution forbedrer den katalytiske effektivitet af en beregningsmæssigt designet biokatalysator med cirka 1000 gange ved at indstille ensemblet af strukturelle delstater, som enzymet kan prøve for at favorisere dem, der er katalytisk kompetente.
Baseret på disse observationer, vi konstruerer en kunstig biokatalysator med en katalytisk effektivitet på niveau med den for det gennemsnitlige naturlige enzym. "
Hvad er den effektfulde opdagelse?
"Vi udviklede en ny beregningsmetode til enzymdesign, der er mere nøjagtig end tidligere metoder, fordi det gør det muligt at tilnærme den iboende fleksibilitet af proteinstilladet, der bruges som en skabelon til design."
Hvorfor er dette vigtigt?
"Dette er vigtigt, fordi tidligere metoder fokuserede på at skabe en stabil struktur, der ignorerer den iboende dynamik i naturlige enzymer, hvilket er afgørende for deres funktion (dvs. enzymer skal "bevæge sig" for at være effektive katalysatorer).
Tidligere har det var ikke kendt, om et kunstigt enzym, der udviser en katalytisk effektivitet på niveau med et naturligt enzym, kunne beregnes beregningsmæssigt. Vi viser, at dette er muligt, men kun ved at bruge et strukturelt ensemble af proteinskabeloner, der tilnærmer sig konformationsfleksibilitet i stedet for en enkelt skabelon som tidligere gjort.
Resultaterne præsenteret i vores manuskript antyder, at beregningsenzymdesign ved hjælp af et strukturelt ensemble kunne forhindre behovet for rettet evolution ved at tillade katalytisk kompetente delstater at blive udtaget under designproceduren. "
Hvad er de potentielle anvendelser af din forskning?
"Hvis vi kunne designe, fra starten, enzymer, der kan katalysere enhver kemisk målreaktion med høj effektivitet, det ville åbne døren til meget værdifulde bioteknologier, der i øjeblikket er utilgængelige ved hjælp af naturlige enzymer. "
Er der noget, du gerne vil tilføje?
Ja, forskning fandt sted fra 2018 til 2020, ved University of Ottawa og University of California, San Francisco.
Papiret "Ensemblebaseret enzymdesign kan rekapitulere virkningerne af laboratorierettet evolution i silico" blev for nylig offentliggjort i Naturkommunikation .
 Varme artikler
Varme artikler
-
 Sådan beregnes elektronernes valens i den periodiske tabelElektroner kredser omkring atomens kerne ved indstillede energiniveauer kendt som primære energiniveauer eller elektronskaller. Hver elektronskal er sammensat af en eller flere underskaller. Pr. Defin
Sådan beregnes elektronernes valens i den periodiske tabelElektroner kredser omkring atomens kerne ved indstillede energiniveauer kendt som primære energiniveauer eller elektronskaller. Hver elektronskal er sammensat af en eller flere underskaller. Pr. Defin -
 De radikale måder, hvorpå sollys bygger større molekyler i atmosfærenKredit:American Chemical Society Med sommeren nærmer sig, hav og sol kan måske fremtrylle billeder af en strandtur. Men for videnskabsmænd, samspillet mellem de to har store konsekvenser for klima
De radikale måder, hvorpå sollys bygger større molekyler i atmosfærenKredit:American Chemical Society Med sommeren nærmer sig, hav og sol kan måske fremtrylle billeder af en strandtur. Men for videnskabsmænd, samspillet mellem de to har store konsekvenser for klima -
 Soltårnet udsætter materialer for intens varme for at teste termisk responsKredit:Sandia National Laboratories Sandia National Laboratories bruger sit soltårn til at hjælpe med at vurdere virkningen af ekstreme temperaturændringer på materialer. Testene, nu på deres a
Soltårnet udsætter materialer for intens varme for at teste termisk responsKredit:Sandia National Laboratories Sandia National Laboratories bruger sit soltårn til at hjælpe med at vurdere virkningen af ekstreme temperaturændringer på materialer. Testene, nu på deres a -
 Stort skridt i at producere kulstofneutralt brændstof:sølvdiphosphidKredit:CC0 Public Domain En ny kemisk proces beskrevet i tidsskriftet Naturkommunikation gør i laboratoriet, hvad træer gør i naturen - det omdanner kuldioxid til brugbare kemikalier eller brænd
Stort skridt i at producere kulstofneutralt brændstof:sølvdiphosphidKredit:CC0 Public Domain En ny kemisk proces beskrevet i tidsskriftet Naturkommunikation gør i laboratoriet, hvad træer gør i naturen - det omdanner kuldioxid til brugbare kemikalier eller brænd
- FORKLARER:Store farer forude for den spanske vulkanø
- Tunguska genbesøgt:111 år gammel mystisk indvirkning inspirerer nye, mere optimistiske asteroide f…
- Gensyn med jordskælvet i Kobe og variationerne i atmosfærisk radonkoncentration
- Iran-satellitten i amerikansk række når ikke i kredsløb
- At have kunder fra mange brancher kan skade revisionsfirmaernes effektivitet
- Sådan finder du skråningen af en plottet linje med TI-84 Plus Silver Edition


