Er SIF6 2- polær eller ikke-polær?
* form: Det centrale siliciumatom har seks fluoratomer omkring det og danner en octahedral form. Denne form er symmetrisk.
* Elektronegativitet: Fluor er meget mere elektronegativ end silicium. Dette betyder, at hvert fluoratom trækker elektrondensitet mod sig selv og skaber et dipolmoment inden for hver Si-F-binding. På grund af den symmetriske octahedrale form annullerer disse individuelle dipolmomenter hinanden imidlertid.
* netto dipolmoment: Da de individuelle dipolmomenter annulleres, har molekylet som helhed et netto dipolmoment på nul.
er derfor Sif6 2- ikke-polær.
Sidste artikelHvor mange mol i 55 g lithiumchlorid?
Næste artikelHvad er opløseligt i et ikke -polært stof?
 Varme artikler
Varme artikler
-
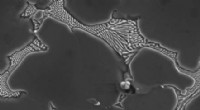 Varmehærdet magnesiumlegering et stærkt valg til implantaterBillede fra elektronmikroskop, der viser et stort bundfald i magnesiumlegering. Disse bundfald opløses ved varmebehandling, hvilket reducerer korrosionshastigheden væsentligt og gør legeringen meget s
Varmehærdet magnesiumlegering et stærkt valg til implantaterBillede fra elektronmikroskop, der viser et stort bundfald i magnesiumlegering. Disse bundfald opløses ved varmebehandling, hvilket reducerer korrosionshastigheden væsentligt og gør legeringen meget s -
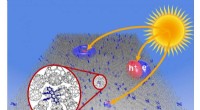 Molekylære vibrationer reducerer den maksimalt opnåelige fotovoltage i organiske solcellerIllustration af generation af ladningspar (excitoner), forløberne til gratis ladningsbærere i det aktive lag af en organisk solcelle. Kredit:Technische Universitaet Dresden Forskere ved TU Dresden
Molekylære vibrationer reducerer den maksimalt opnåelige fotovoltage i organiske solcellerIllustration af generation af ladningspar (excitoner), forløberne til gratis ladningsbærere i det aktive lag af en organisk solcelle. Kredit:Technische Universitaet Dresden Forskere ved TU Dresden -
 En billigere måde at opskalere atomlagsaflejring påKunstnerisk illustration af atomlagsaflejring. Kredit:J. Luterbacher Kemiingeniører ved EPFL har udviklet en ny metode til atomlagsaflejring, en teknik, der almindeligvis anvendes i mikroelektroni
En billigere måde at opskalere atomlagsaflejring påKunstnerisk illustration af atomlagsaflejring. Kredit:J. Luterbacher Kemiingeniører ved EPFL har udviklet en ny metode til atomlagsaflejring, en teknik, der almindeligvis anvendes i mikroelektroni -
 Mærkning af brystimplantater med tomat -DNA for at forhindre forfalskningDr. Storsberg, videnskabsmand ved Fraunhofer IAP og et ekspertvidne i retssager centreret om brystimplantater, undersøger et brystimplantat med en utæt gelfyldning. Kredit:Fraunhofer IAP Årevis, e
Mærkning af brystimplantater med tomat -DNA for at forhindre forfalskningDr. Storsberg, videnskabsmand ved Fraunhofer IAP og et ekspertvidne i retssager centreret om brystimplantater, undersøger et brystimplantat med en utæt gelfyldning. Kredit:Fraunhofer IAP Årevis, e
- når der arbejdes på et system af en ekstern kraft, systemet?
- Tulipaner fra Amsterdam? Ikke så meget siger ny sonde
- Hvor høj er 1,57 m i fødderne?
- Vi skal vågne op til den ødelæggende virkning af nitrogen, siger forskere
- Sådan testes en rock for guld
- Hvis en befolkning af larver lever af blade træer i skov og drej mad til fugle, der spiser dem fra,…


