Forklar, hvorfor den procentvise sammensætning af visse forbindelser ikke er tilstrækkelige til at bestemme molekylære formler?
* Flere forbindelser kan have den samme procentdel sammensætning: Overvej følgende eksempler:
* formaldehyd (CH₂O) har en procentdel sammensætning på 40% kulstof, 6,7% brint og 53,3% ilt.
* eddikesyre (c₂h₄o₂) Har også en procentdel sammensætning på 40% kulstof, 6,7% brint og 53,3% ilt.
Selvom begge har den samme procentvise sammensætning, har de meget forskellige molekylære formler.
* procentsammensætning repræsenterer forhold, ikke nøjagtige tal: Procentkomposition fortæller os forholdet mellem elementer i forbindelsen. For eksempel kunne en forbindelse med en procentvis sammensætning på 85,7% kulstof og 14,3% brint være:
* ch₂ (enkleste forhold)
* c₂h₄
* c₃h₆ og så videre.
For at bestemme den molekylære formel har du brug for yderligere oplysninger:
* molmasse (molekylvægt): At kende den molære masse af forbindelsen giver dig mulighed for at beregne det nøjagtige antal af hvert element, der er til stede i molekylet.
* Empirisk formel: Denne formel repræsenterer det enkleste forhold mellem hele antal elementer i forbindelsen. Du kan bestemme den molekylære formel fra den empiriske formel og den molære masse.
Kortfattet
Procentsammensætning er et nyttigt værktøj til at forstå de relative andele af elementer i en forbindelse, men det er utilstrækkeligt til at bestemme den faktiske molekylære formel. Du har brug for yderligere oplysninger, såsom molmasse, for at bestemme det nøjagtige antal atomer i hvert element i molekylet.
 Varme artikler
Varme artikler
-
 Mindre fugt i naturlige fibreFor at gøre de naturlige fibre mere modstandsdygtige, rovingen er imprægneret med monomerer:polymerisationen fortsætter derefter inde i garnet. Kredit:Fraunhofer LBF Naturfibre har mange fordele:d
Mindre fugt i naturlige fibreFor at gøre de naturlige fibre mere modstandsdygtige, rovingen er imprægneret med monomerer:polymerisationen fortsætter derefter inde i garnet. Kredit:Fraunhofer LBF Naturfibre har mange fordele:d -
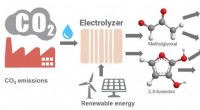 Hvordan man omdanner klimaforandrende kuldioxid til plast og andre produkterDette billede viser, hvordan kuldioxid kan omdannes elektrokemisk til værdifulde polymer- og lægemiddelprækursorer. Kredit:Karin Calvinho/Rutgers University-New Brunswick Rutgers-forskere har udvi
Hvordan man omdanner klimaforandrende kuldioxid til plast og andre produkterDette billede viser, hvordan kuldioxid kan omdannes elektrokemisk til værdifulde polymer- og lægemiddelprækursorer. Kredit:Karin Calvinho/Rutgers University-New Brunswick Rutgers-forskere har udvi -
 Farvestoffer opdager sygdom gennem hjerteslagssignalerUConn Health-forskere udviklede og patenterede spændingsfølsomme farvestoffer, der forårsager celler, væv, eller hele organer lyser op som følge af elektriske impulser og gør det muligt at måle denne
Farvestoffer opdager sygdom gennem hjerteslagssignalerUConn Health-forskere udviklede og patenterede spændingsfølsomme farvestoffer, der forårsager celler, væv, eller hele organer lyser op som følge af elektriske impulser og gør det muligt at måle denne -
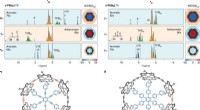 Største rekord for aromatisk ringstørrelse brudt med 162 π elektronerH NMR-spektre af de aromatiske og antiaromatiske seks-porphyrin nanoreringsskabelonkomplekser i oxidationstilstande 2+, 4+ og 6+. Kredit: Naturkemi (2020). DOI:10.1038/s41557-019-0398-3 Et team
Største rekord for aromatisk ringstørrelse brudt med 162 π elektronerH NMR-spektre af de aromatiske og antiaromatiske seks-porphyrin nanoreringsskabelonkomplekser i oxidationstilstande 2+, 4+ og 6+. Kredit: Naturkemi (2020). DOI:10.1038/s41557-019-0398-3 Et team
- Forskere viser, hvad der skal til for at få potentielt brændstofråvare til et reaktivt sted på m…
- Stigende boligudgifter re-segregerer Bay Area, viser undersøgelse
- Celler går på væsker lidt ligesom gekkoer
- Vil hjerne-computer-grænseflader gøre viden streambar?
- Mandlige kunstnere dominerer gallerier. Er det fordi 'kvinder ikke maler særlig godt' eller bare di…
- Hvordan vælger udviklende rygmarv 'hoveder' eller 'haler'?


