8. På de fleste periodiske tabeller er en enkelt atommasse anført i stedet for tallene for alle stabile isotoper. Hvordan dette relaterede til forskellige isotoper?
Sådan relaterer det sig til forskellige isotoper:
* isotoper er atomer med det samme element, der har det samme antal protoner (atomnummer), men forskellige antal neutroner. Denne forskel i neutroner fører til forskellige atommasser for hver isotop.
* relativ overflod henviser til andelen af hver isotop, der findes naturligt. Nogle isotoper er mere almindelige end andre.
* gennemsnitlig atommasse beregnes ved at multiplicere massen af hver isotop med dens relative overflod og derefter opsummere resultaterne. Dette giver os et vægtet gennemsnit, der repræsenterer den typiske masse af et atom af dette element.
Eksempel:
* Carbon har to hovedisotoper:carbon-12 (med 6 protoner og 6 neutroner) og carbon-13 (med 6 protoner og 7 neutroner).
* Carbon-12 har en relativ overflod på ca. 98,9%, mens Carbon-13 har en relativ overflod på ca. 1,1%.
* Den gennemsnitlige atommasse af kulstof beregnes som:
(12 amu * 0,989) + (13 amu * 0,011) =12,01 amu
I bund
Sidste artikelHvilket element er et ikke -metal i periode 3 atommasse 12?
Næste artikelElement med 207 som det atommasse nummer?
 Varme artikler
Varme artikler
-
 Ny algoritme kan hurtigere forudsige LED-materialerForskere fra University of Houston har udtænkt en ny maskinlæringsalgoritme, der er effektiv nok til at køre på en personlig computer og forudsige egenskaberne af mere end 100, 000 forbindelser på jag
Ny algoritme kan hurtigere forudsige LED-materialerForskere fra University of Houston har udtænkt en ny maskinlæringsalgoritme, der er effektiv nok til at køre på en personlig computer og forudsige egenskaberne af mere end 100, 000 forbindelser på jag -
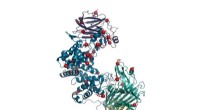 Omkonstrueret enzym kan hjælpe med at vende skader fra rygmarvsskade og slagtilfældeI denne gengivelse af enzymet chondroitinase ABC, punktmutationer repræsenteres af røde kugler. Denne re-manipulerede form af enzymet er mere stabil og mere aktiv end vildtypen og kan bruges til at hj
Omkonstrueret enzym kan hjælpe med at vende skader fra rygmarvsskade og slagtilfældeI denne gengivelse af enzymet chondroitinase ABC, punktmutationer repræsenteres af røde kugler. Denne re-manipulerede form af enzymet er mere stabil og mere aktiv end vildtypen og kan bruges til at hj -
 Vibration kun i én retningDet nydesignede materiale. Den transmitterer vibrationer fra venstre mod højre, men ikke fra højre mod venstre. Kredit:UvA/Brandenbourger et al. Elektroniske komponenter såsom transistorer transmi
Vibration kun i én retningDet nydesignede materiale. Den transmitterer vibrationer fra venstre mod højre, men ikke fra højre mod venstre. Kredit:UvA/Brandenbourger et al. Elektroniske komponenter såsom transistorer transmi -
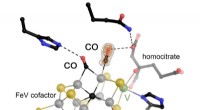 Vanadiumafhængig nitrogenase kan binde to CO-molekyler samtidigtJern-vanadium (FeV) cofaktoren i vanadiumafhængig nitrogenase blev lavet til at reagere med carbonmonoxid (CO) og derefter gasset under tryk, tillader to molekyler af substratet at blive visualiseret
Vanadiumafhængig nitrogenase kan binde to CO-molekyler samtidigtJern-vanadium (FeV) cofaktoren i vanadiumafhængig nitrogenase blev lavet til at reagere med carbonmonoxid (CO) og derefter gasset under tryk, tillader to molekyler af substratet at blive visualiseret
- Ny undersøgelse viser igen, at Einstein har ret:Den mest grundige test til dato finder ingen Lorent…
- At finde fødevaresikkerhed under vandet
- Boeing søger $60 mia. i amerikansk støtte til rumfartsindustrien
- Coronavirus:Strategisk nationalt lager var klar, men ikke for dette
- NASA finder Tropical Cyclone Harold mellem Vanuatu og Fiji
- Effekten af sort lys på planter


