Er molene konserveret i en afbalancerede kemiske ligninger?
* loven om bevarelse af masse: Denne grundlæggende lov hedder det, at der ikke kan skabes materie eller ødelægges i almindelige kemiske reaktioner. Dette betyder, at den samlede masse af reaktanter skal svare til den samlede masse af produkter.
* mol repræsenterer mængde: Mol er en måleenhed for mængden af stof. En mol af et stof indeholder det samme antal partikler (atomer, molekyler osv.) Som en mol af et andet stof.
* afbalanceringsligninger: Afbalancering af kemiske ligninger sikrer, at antallet af atomer i hvert element på reaktantens side svarer til antallet af atomer i dette element på produktsiden. Da molen repræsenterer mængden af stof, betyder det, at antallet af mol reaktanter skal svare til antallet af mol produkter.
Eksempel:
Overvej den afbalancerede ligning for forbrænding af metan:
`` `
CH4 + 2O2 -> CO2 + 2H2O
`` `
* reaktanter: 1 mol metan (CH4) og 2 mol ilt (O2)
* Produkter: 1 mol kuldioxid (CO2) og 2 mol vand (H2O)
Vi kan se, at det samlede antal mol reaktanter (1 + 2 =3) er lig med det samlede antal mol produkter (1 + 2 =3).
Vigtig note: Mens mol er konserveret, er antallet af molekyler eller atomer muligvis ikke. I metanforbrændingseksemplet har vi for eksempel 1 molekyle methan og 2 molekyler af iltreaktion på dannelse af 1 molekyle af kuldioxid og 2 molekyler vand.
 Varme artikler
Varme artikler
-
 Effektiv kuldioxidreduktion under synligt lys med en ny, billig katalysatorDenne videnskabelige illustration af undersøgelsen blev valgt som forsidebillede i ACS Catalysis . Kredit:Tokyo Institute of Technology En ny koordinationspolymer-baseret fotokatalysator for CO2 re
Effektiv kuldioxidreduktion under synligt lys med en ny, billig katalysatorDenne videnskabelige illustration af undersøgelsen blev valgt som forsidebillede i ACS Catalysis . Kredit:Tokyo Institute of Technology En ny koordinationspolymer-baseret fotokatalysator for CO2 re -
 En ny gelelektroforese teknik til hurtig biomarkørdiagnose via massespektrometriOpløselige BAC-tværbundne geler muliggør hurtig og tabsfri genvinding af proteinbiomarkører adskilt af SDS-polyacrylamidgelelektroforese og letter analyse ved massespektrometri. Kredit: Journal of Pro
En ny gelelektroforese teknik til hurtig biomarkørdiagnose via massespektrometriOpløselige BAC-tværbundne geler muliggør hurtig og tabsfri genvinding af proteinbiomarkører adskilt af SDS-polyacrylamidgelelektroforese og letter analyse ved massespektrometri. Kredit: Journal of Pro -
 Surroundlyd fra letvægts rulle-til-rulle trykt højttalerpapirTrykte højttalere skaber overraskende jungle-illusion. Trykt elektronik indlejret i en papirbane muliggør 360° surroundsound. Varvara Bachul fra Institute of Print and Media Technology ved Chemnitz Un
Surroundlyd fra letvægts rulle-til-rulle trykt højttalerpapirTrykte højttalere skaber overraskende jungle-illusion. Trykt elektronik indlejret i en papirbane muliggør 360° surroundsound. Varvara Bachul fra Institute of Print and Media Technology ved Chemnitz Un -
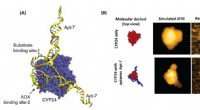 Lovende anticancer-molekyle identificeretFigur 1. En integreret tilgang til HS-AFM og molekylær docking for at afsløre bindingsmekanismen for Apt-7 til CYP24 (A) Den tredimensionelle visning af de toprangerede dockede konformationer af CYP24
Lovende anticancer-molekyle identificeretFigur 1. En integreret tilgang til HS-AFM og molekylær docking for at afsløre bindingsmekanismen for Apt-7 til CYP24 (A) Den tredimensionelle visning af de toprangerede dockede konformationer af CYP24
- En klimaskurk? Måling og styring af kødets indvirkning på planeten
- Ny elektronmikroskopiteknik til termiske diffusionsmålinger
- Forsker afslører værktøj til en renere lang ø-lyd
- Hvad er molariteten af en 0,050 N H2SO4 opløsning?
- Hvor mange meter er to og en halv acre?
- Hvad er en affyringsrampe lavet af?


