Hvad er forskellen mellem proces med kogning og fordampningsvand?
kogning:
* defineret temperatur: Kogning forekommer ved en bestemt temperatur, kaldet kogepunktet. For vand er dette 100 ° C (212 ° F) ved standard atmosfærisk tryk.
* forekommer i hele væsken: Bobler dannes inden i væsken, når den når sit kogepunkt, og vanddampen fordampes gennem hele væsken.
* kræver energiindgang: Energi er nødvendig for at bryde bindingerne mellem vandmolekyler og give dem mulighed for at flygte som damp. Denne energi leveres normalt af varme.
* synlig og hurtig: Du kan se boblerne dannes og vandet blive til damp. Processen er relativt hurtig.
Fordampning:
* forekommer ved enhver temperatur: Fordampning kan ske ved enhver temperatur under kogepunktet.
* forekommer ved overfladen: Fordampning sker kun ved overfladen af væsken. Vandmolekyler med nok energi undgår væsken og bliver damp.
* kan forekomme uden yderligere energiindgang: Fordampning kan ske selv uden ekstern varme, så længe der er nok energi i vandmolekylerne på overfladen. Imidlertid fremskynder varmeprocessen.
* mindre synlig og gradvis: Du kan ikke se, at vandet bliver til damp, og processen kan være meget langsommere end kogende.
Her er en analogi:
Forestil dig en gryde med vand på komfuret. kogning er som vandet hurtigt boblende og dampende, når du drejer ovnen højt. Fordampning er som den langsomme, stabile fordampning af vandet i gryden, hvis du lader det være på tælleren ved stuetemperatur.
Kortfattet:
| Funktion | Kogning | Fordampning |
| --- | --- | --- |
| Temperatur | Specifik (kogepunkt) | Enhver temperatur under kogepunktet |
| Placering | Gennem væsken | På overfladen |
| Energiindgang | Krævet | Kan forekomme uden yderligere input |
| Synlighed | Synlig, hurtig | Mindre synlig, gradvis |
Begge processer er vigtige i vandcyklussen og bidrager til den samlede balance mellem vand på jorden.
Sidste artikelHvilket nyttigt stof gør fotosyntesen for anlægget?
Næste artikelEr fordampning det samme som kogning?
 Varme artikler
Varme artikler
-
 Forskere opdager, at tung elementkemi kan ændre sig ved højt trykCurium krystaller med en orange glød, som forskerne brugte til at overvåge ændringerne i kemien, mens de påførte pres. Kredit:Thomas Albrecht-Schmitt / Nature Ny forskning viser, at et af de tunge
Forskere opdager, at tung elementkemi kan ændre sig ved højt trykCurium krystaller med en orange glød, som forskerne brugte til at overvåge ændringerne i kemien, mens de påførte pres. Kredit:Thomas Albrecht-Schmitt / Nature Ny forskning viser, at et af de tunge -
 Kemiske biologer afdækker årsagen til en sjælden hjernesygdommaj Khanna, PhD, venstre, bruger 3D-briller til at hjælpe med at visualisere et molekyle skabt i hendes laboratorium. Kredit:Nadia Whitehead / UA College of Medicine -Tucson Babyer født med pontoc
Kemiske biologer afdækker årsagen til en sjælden hjernesygdommaj Khanna, PhD, venstre, bruger 3D-briller til at hjælpe med at visualisere et molekyle skabt i hendes laboratorium. Kredit:Nadia Whitehead / UA College of Medicine -Tucson Babyer født med pontoc -
 Hvordan man udvider og kontraherer buede overflader af alle formerForskere ved TU Delfts afdeling for Precision and Microsystems Engineering (PME) har designet en dilatationsmetode, som kan anvendes på enhver buet overflade. Denne universelle metode kan have en rækk
Hvordan man udvider og kontraherer buede overflader af alle formerForskere ved TU Delfts afdeling for Precision and Microsystems Engineering (PME) har designet en dilatationsmetode, som kan anvendes på enhver buet overflade. Denne universelle metode kan have en rækk -
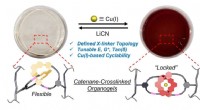 Sammenlåsende ringe låser op for nye materialeegenskaberAmatørkemikere husker måske, at kobber (Cu) normalt fremstår blåt i vand og grønt, når det er bundet af en standard ikke-aromatisk ligand. Men i tilfældet med de metalholdige catenaner, der er skabt i
Sammenlåsende ringe låser op for nye materialeegenskaberAmatørkemikere husker måske, at kobber (Cu) normalt fremstår blåt i vand og grønt, når det er bundet af en standard ikke-aromatisk ligand. Men i tilfældet med de metalholdige catenaner, der er skabt i
- Qualcomm viser 5G-teknologien frem ved China Unicom-begivenheden
- Hvorfor kan densitet bruges til at adskille guld fra omgivende materiale?
- Vulkanbølge indsnævrede havene under ældgammel global opvarmningsbegivenhed
- Oldtidens Palmyra - en historie om urban modstandskraft
- Hvad bruges udtrykket til at beskrive evnen til at producere et specifikt produkt mere effektivt end…
- Hvordan kan du sige, at et kulstof i molekyle er chiral?


