Påvirker mængden af gas adfærdsgas?
Det korte svar: Ja, mængden af gas kan påvirke dens opførsel på flere måder.
Her er hvordan:
* tryk: Flere gasmolekyler i en beholder betyder flere kollisioner med beholdervæggene, hvilket resulterer i højere tryk. Dette er beskrevet af den ideelle gaslov:PV =NRT, hvor P er tryk, V er volumen, N er antallet af mol (mængde) gas, R er den ideelle gaskonstant, og T er temperatur.
* bind: Hvis du øger mængden af gas i en fast volumenbeholder, vil trykket stige. Hvis du tillader volumen at udvide, falder trykket (under forudsætning af konstant temperatur).
* Temperatur: Mængden af gas kan påvirke temperaturændringen, når varmen tilsættes eller fjernes. En større mængde gas kræver mere energi for at hæve temperaturen.
* diffusion og effusion: Diffusionshastigheden (spredning) og effusion (undslip gennem et lille hul) af en gas er relateret til dens molekylvægt. Mens mængden af gas ikke direkte ændrer sin molekylvægt, vil en større mængde gas betyde flere molekyler, der diffunderer eller effuserer over tid.
Vigtig note: Opførslen af reelle gasser kan være mere kompliceret, end den ideelle gaslov forudsiger, især ved høje tryk eller lave temperaturer. Ægte gasmolekyler har interaktioner med hinanden, hvilket kan påvirke deres opførsel.
Lad mig vide, om du gerne vil udforske nogen af disse koncepter yderligere eller have mere specifikke spørgsmål om gasadfærd!
Sidste artikelHvad er den kemiske formel for jordbærekstrakt?
Næste artikelHvad er PTB med kavitærdannelse?
 Varme artikler
Varme artikler
-
 Første store undersøgelse af kokainbrugere fører til gennembrud inden for lægemiddeltestEn bunke kokainhydrochlorid. Kredit:DEA Drug Enforcement Agency, offentligt domæne Forskere fra University of Surrey har udviklet en hurtig og meget følsom fingeraftrykstest, der kan tage kun seku
Første store undersøgelse af kokainbrugere fører til gennembrud inden for lægemiddeltestEn bunke kokainhydrochlorid. Kredit:DEA Drug Enforcement Agency, offentligt domæne Forskere fra University of Surrey har udviklet en hurtig og meget følsom fingeraftrykstest, der kan tage kun seku -
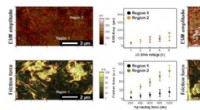 Visualisering af funktionelle komponenter for at karakterisere optimale kompositelektroderAFM -billeder af (a, c) prøver A og (b, d) B. (a, b) Topografiske højdebilleder og (c, d) friktionskraftbilleder, henholdsvis. Alle billeder blev optaget med en spidsbelastningskraft på 400 nN. Røde l
Visualisering af funktionelle komponenter for at karakterisere optimale kompositelektroderAFM -billeder af (a, c) prøver A og (b, d) B. (a, b) Topografiske højdebilleder og (c, d) friktionskraftbilleder, henholdsvis. Alle billeder blev optaget med en spidsbelastningskraft på 400 nN. Røde l -
 Revner i perovskitfilm til solceller kan let heles, undersøgelse finderEn revnet perovskitfilm (til venstre) kan heles fuldstændigt (højre) med en vis komprimering af lidt varme, ny forskning viser. Resultaterne lover godt for den langsigtede pålidelighed af perovskitfil
Revner i perovskitfilm til solceller kan let heles, undersøgelse finderEn revnet perovskitfilm (til venstre) kan heles fuldstændigt (højre) med en vis komprimering af lidt varme, ny forskning viser. Resultaterne lover godt for den langsigtede pålidelighed af perovskitfil -
 Stort skridt i at producere kulstofneutralt brændstof:sølvdiphosphidKredit:CC0 Public Domain En ny kemisk proces beskrevet i tidsskriftet Naturkommunikation gør i laboratoriet, hvad træer gør i naturen - det omdanner kuldioxid til brugbare kemikalier eller brænd
Stort skridt i at producere kulstofneutralt brændstof:sølvdiphosphidKredit:CC0 Public Domain En ny kemisk proces beskrevet i tidsskriftet Naturkommunikation gør i laboratoriet, hvad træer gør i naturen - det omdanner kuldioxid til brugbare kemikalier eller brænd
- Når der ikke er nogen brydning af lys, og hvorfor sker det?
- Opdagelse af artefakter standser noget arbejde på marinebasen på Guam
- Forskning afslører, hvordan materialer direkte cellerespons
- Hvorfor børn lærer at sige ske før himlen
- Israelsk museum forklarer emojis fra det gamle Egypten
- Ny undersøgelse fremhæver rewildings rolle i håndteringen af oversvømmelser og tørkeudfordrin…


