Hvorfor er ædle gasser stabile, mens alkalimetaller ikke?
ædle gasser:
* Fuld valence Shell: Noble gasser har en fuld ydre skal af elektroner, hvilket betyder, at de har det maksimale antal elektroner, som deres yderste energiniveau kan indeholde (f.eks. Har Helium 2 elektroner i sin første skal, Neon har 8 i sit andet).
* Lav energi tilstand: Denne fulde ydre skalkonfiguration repræsenterer en meget stabil og lavenergitilstand. Atomer stræber efter at opnå denne stabile tilstand, da den minimerer deres energi.
* ureaktiv: Da de allerede har en stabil konfiguration, vinder eller mister ædle gasser ikke let elektroner, hvilket gør dem ekstremt ureaktive.
alkalimetaller:
* en valenselektron: Alkalimetaller har kun et elektron i deres yderste skal.
* Højenergistat: Denne enkelt elektron går let tabt, hvilket efterlader en positiv ion med en komplet ydre skal.
* Meget reaktiv: Alkalimetaller mister let deres valenselektron for at opnå en stabil konfiguration, hvilket gør dem meget reaktive. De danner let ioniske bindinger med ikke-metaler.
Kortfattet:
* ædle gasser er stabile, fordi de har en fuld valensskal, hvilket gør dem ureaktive.
* alkalimetaller er meget reaktive, fordi de kun har en valenselektron, som de let mister for at opnå en stabil konfiguration.
Sidste artikelHvorfor er polære aggralente obligationer vigtige?
Næste artikelHvorfor er polært vandsalt end andet havvand?
 Varme artikler
Varme artikler
-
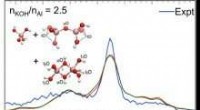 Aluminiumskomplekser identificeret via vibrationsfingeraftrykRamanspektre af opløsninger sammensat af en aluminatmonomer og to dimere arter. Vibrationsbånd forudsagt af ab-initio molekylær dynamik (AIMD) vist i rødt og grønt. Overlappende IR- og Raman-bånd får
Aluminiumskomplekser identificeret via vibrationsfingeraftrykRamanspektre af opløsninger sammensat af en aluminatmonomer og to dimere arter. Vibrationsbånd forudsagt af ab-initio molekylær dynamik (AIMD) vist i rødt og grønt. Overlappende IR- og Raman-bånd får -
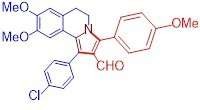 En række stoffer med antitumor -egenskaber syntetiseretStrukturen af en af de resulterende forbindelser (2-aryl-5, 6-dihydropyrrolo [2, 1-α] isoquinoline) Kredit:Maria Matveeva Forskere fra RUDN University har syntetiseret en række nye cytotoksisk
En række stoffer med antitumor -egenskaber syntetiseretStrukturen af en af de resulterende forbindelser (2-aryl-5, 6-dihydropyrrolo [2, 1-α] isoquinoline) Kredit:Maria Matveeva Forskere fra RUDN University har syntetiseret en række nye cytotoksisk -
 Ny med-tech zinksensor udvikletCNBP -forsker Dr Sabrina Heng. Kredit:CNBP En ny zinksensor er blevet udviklet af forskere, hvilket giver mulighed for en dybere forståelse af de dynamiske roller, metalioner spiller i regulering
Ny med-tech zinksensor udvikletCNBP -forsker Dr Sabrina Heng. Kredit:CNBP En ny zinksensor er blevet udviklet af forskere, hvilket giver mulighed for en dybere forståelse af de dynamiske roller, metalioner spiller i regulering -
 Studer polyfarmakologi tidligere i lægemiddelopdagelsen, siger forskereKredit:CC0 Public Domain Polyfarmakologi - et lægemiddels evne til at påvirke mere end ét protein - bør studeres tidligt i lægemiddelopdagelsesforløbet, og konstant overvåget, da den kemiske struk
Studer polyfarmakologi tidligere i lægemiddelopdagelsen, siger forskereKredit:CC0 Public Domain Polyfarmakologi - et lægemiddels evne til at påvirke mere end ét protein - bør studeres tidligt i lægemiddelopdagelsesforløbet, og konstant overvåget, da den kemiske struk
- NASA viser ny tongansk ø lavet af tuff ting, sandsynligvis vedvare år
- Hvordan kræftceller spredes og presses gennem bittesmå blodkar
- Ny teori hæver det, vi ved om, hvordan ladede makromolekyler samler sig selv
- 132 gram at kommunikere med Mars
- Facebook beskæftiger sig med kinesisk fast træk fra amerikanske lovgivere
- Hvem opfandt magnetismen?


