Hvordan udtrykker du opløselighed?
1. Kvalitativ beskrivelse:
* opløselig: Opløsningen opløses fuldstændigt i opløsningsmidlet.
* uopløselig: Opløsningen opløses ikke markant i opløsningsmidlet.
* Delvis opløselig: Opløsningen opløses i et begrænset omfang i opløsningsmidlet.
2. Kvantitative udtryk:
* Koncentration: Dette er den mest almindelige måde at udtrykke opløselighed på. Det henviser til mængden af opløst stof opløst i en given mængde opløsningsmiddel. Flere enheder kan bruges, herunder:
* Molaritet (M): Mol opløst stof pr. Liter opløsning.
* molalitet (m): Mol opløst stof pr. Kg opløsningsmiddel.
* masseprocent (%): Masse af opløst stof pr. 100 enheder af løsning af opløsning.
* dele pr. million (ppm): Masse af opløst stof pr. Million enheder af løsning af opløsning.
* dele pr. milliard (ppb): Masse af opløst stof pr. Milliarder enhed af løsning af opløsning.
* opløselighedsprodukt (KSP): Dette er en konstant, der beskriver opløseligheden af en sparsomt opløselig ionisk forbindelse. Det defineres som produktet af koncentrationerne af ionerne i en mættet opløsning, der hver især hæves til kraften i dens støkiometriske koefficient.
* Mætningspunkt: Dette henviser til den maksimale mængde opløst stof, der kan opløses i en given mængde opløsningsmiddel ved en bestemt temperatur og tryk.
3. Grafisk repræsentation:
* opløselighedskurver: Disse grafer viser opløseligheden af et stof som en funktion af temperaturen. De giver en visuel repræsentation af, hvordan opløselighed ændrer sig med temperaturen.
4. Andre udtryk:
* mættet løsning: En opløsning, der indeholder den maksimale mængde opløst stof, der kan opløses ved en given temperatur og tryk.
* Umættet løsning: En opløsning, der indeholder mindre end den maksimale mængde opløst stof, der kan opløses ved en given temperatur og tryk.
* overmættet løsning: En løsning, der indeholder mere opløst stof, end den normalt kan indeholde ved en given temperatur og tryk. Dette er normalt ustabilt, og det overskydende opløsningsmiddel udfældes, hvis det forstyrres.
Vigtig note: Opløselighed er et komplekst fænomen påvirket af faktorer som temperatur, tryk og arten af opløst og opløsningsmiddel.
Sidste artikelHvor mange drams i en væske en gang?
Næste artikelNår mættede opløsninger er de normalt umættede?
 Varme artikler
Varme artikler
-
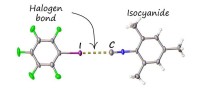 Ny ikke -kovalent binding blokerer frastødende lugt af isocyaniderStrukturen af associerede iodopentafluorobensen med mesityl isocyanid, etableret ved røntgendiffraktion ved Research Park ved St. Petersburg State University. Kredit:SPbU Isocyanider er en vigti
Ny ikke -kovalent binding blokerer frastødende lugt af isocyaniderStrukturen af associerede iodopentafluorobensen med mesityl isocyanid, etableret ved røntgendiffraktion ved Research Park ved St. Petersburg State University. Kredit:SPbU Isocyanider er en vigti -
 Fremstilling af biologiske lægemidler med edderkoppesilkeproteinSpringende edderkop. Kredit:Lena Holm Forskere ved Karolinska Institutet i Sverige har formået at syntetisere lungeoverfladeaktivt stof, et lægemiddel, der bruges til pleje af premature babyer, ve
Fremstilling af biologiske lægemidler med edderkoppesilkeproteinSpringende edderkop. Kredit:Lena Holm Forskere ved Karolinska Institutet i Sverige har formået at syntetisere lungeoverfladeaktivt stof, et lægemiddel, der bruges til pleje af premature babyer, ve -
 Cryo-EM afslører kritisk protein-modificerende kompleks og potentielt lægemiddelmålForskere har afsløret strukturen på atomniveau af et molekylært kompleks, der er ansvarligt for at modificere proteiner, muligvis baner vejen for udvikling af ny medicin mod kræft og en lang række and
Cryo-EM afslører kritisk protein-modificerende kompleks og potentielt lægemiddelmålForskere har afsløret strukturen på atomniveau af et molekylært kompleks, der er ansvarligt for at modificere proteiner, muligvis baner vejen for udvikling af ny medicin mod kræft og en lang række and -
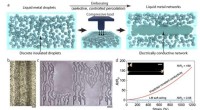 Selvhelbredende flydende metal-elastomererSkaber robuste ledende spor. (a) Skema til at illustrere processen med prægning, hvor diskrete isolerende dråber af flydende metal er selektivt præget for at danne et forbundet ledende netværk. (b) Op
Selvhelbredende flydende metal-elastomererSkaber robuste ledende spor. (a) Skema til at illustrere processen med prægning, hvor diskrete isolerende dråber af flydende metal er selektivt præget for at danne et forbundet ledende netværk. (b) Op
- Hvordan Space Wars vil fungere
- Syntetisering af zeolitter i nanostørrelse
- Forskere opdager, hvordan højenergielektroner styrker magnetiske felter
- Hvad er ligheder mellem æggeskaller og tænder?
- Hvad er det vigtigste forurenende stof, der frigives ved kulafbrænding?
- Sådan bestemmes styrken af en Electromagnet


