Hvilken komponent reduceres under elektrolysen af saltvand?
Her er hvorfor:
* elektrolyse: Denne proces bruger elektricitet til at drive ikke-spontane kemiske reaktioner.
* katode: Den negative elektrode, hvor reduktion (forstærkning af elektroner) forekommer.
* anode: Den positive elektrode, hvor oxidation (tab af elektroner) forekommer.
Ved saltvandelektrolyse forekommer følgende reaktioner:
* ved katoden (reduktion):
* 2H2O (L) + 2E- → H2 (G) + 2OH- (aq)
* Na + (aq) + e- → NA (s)
* ved anoden (oxidation):
* 2Cl- (aq) → Cl2 (g) + 2e-
Mens begge reaktioner er mulige ved katoden, foretrækkes reduktionen af vand på grund af dets lavere standardreduktionspotentiale. Tilstedeværelsen af en kviksølvkatode kan imidlertid sænke reduktionspotentialet for natriumioner betydeligt, hvilket gør dem til den primære art reduceret.
Derfor er natriumioner reduceret til natriummetal Ved katoden under elektrolyse af saltvand, specifikt når der anvendes en kviksølvkatode.
 Varme artikler
Varme artikler
-
 I formhukommelseslegeringer, den rigtige kombination af krystalkorn kan opnå høj styrke og stadig …Simuleret formhukommelsesfaseovergang i en formhukommelseslegering med små og store krystalkorn. Kredit:IOP Publishing A*STAR forskere har vist, gennem en supercomputersimulering, at høj styrke og
I formhukommelseslegeringer, den rigtige kombination af krystalkorn kan opnå høj styrke og stadig …Simuleret formhukommelsesfaseovergang i en formhukommelseslegering med små og store krystalkorn. Kredit:IOP Publishing A*STAR forskere har vist, gennem en supercomputersimulering, at høj styrke og -
 Hvad er forskellen mellem relativ luftfugtighed og dugpunkt?Kredit:The American Chemical Society Meteorologer rapporterer ofte mængden af fugt i luften som relativ fugtighed eller dugpunkt. Disse foranstaltninger kan være forvirrende for folk, der bare
Hvad er forskellen mellem relativ luftfugtighed og dugpunkt?Kredit:The American Chemical Society Meteorologer rapporterer ofte mængden af fugt i luften som relativ fugtighed eller dugpunkt. Disse foranstaltninger kan være forvirrende for folk, der bare -
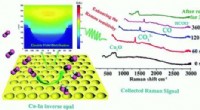 Elektroder varme kanter omdanner CO2 -gas til brændstoffer og kemikalierKredit: Journal of Materials Chemistry A (2019). DOI:10.1039/C9TA02288K Et team af forskere har skabt en skålformet elektrode med varme kanter, som effektivt kan omdanne CO 2 fra gas til kulsto
Elektroder varme kanter omdanner CO2 -gas til brændstoffer og kemikalierKredit: Journal of Materials Chemistry A (2019). DOI:10.1039/C9TA02288K Et team af forskere har skabt en skålformet elektrode med varme kanter, som effektivt kan omdanne CO 2 fra gas til kulsto -
 Ny test identificerer giftige svampeSpiselige og giftige svampe indsamlet fra naturen kan være svære at skelne fra hinanden. Kredit:Candace Bever, ARS-USDA En enkel, bærbar test, der kan påvise den dødeligste af svampegiftene på få
Ny test identificerer giftige svampeSpiselige og giftige svampe indsamlet fra naturen kan være svære at skelne fra hinanden. Kredit:Candace Bever, ARS-USDA En enkel, bærbar test, der kan påvise den dødeligste af svampegiftene på få


