Hvis 5,50 mol butan reageres, hvor mange mol vanddamp produceret?
1. Skriv den afbalancerede kemiske ligning til forbrænding af butan:
C₄H₁₀ (G) + 13/2 O₂ (G) → 4 CO₂ (G) + 5 H₂O (G)
2. Bestem molforholdet mellem butan og vand:
Fra den afbalancerede ligning ser vi, at 1 mol butan (C₄H₁₀) producerer 5 mol vand (H₂O).
3. Beregn molen af produceret vand:
Da vi har 5,50 mol butan, og molforholdet er 1:5, kan vi beregne molen af produceret vand:
5,50 mol c₄h₁₀ * (5 mol H₂O / 1 mol c₄h₁₀) = 27,5 mol H₂O
Derfor produceres 27,5 mol vanddamp, når 5,50 mol butan reageres.
 Varme artikler
Varme artikler
-
 Undersøgelsen sigter mod at øge antitumoral aktivitet af forbindelse ekstraheret fra en Amazon-pla…Uncaria guianensis, i flor, Cacuri, Venezuela. CC3.0 Forskere i Brasilien har udarbejdet modificerede former af alkaloiderne produceret af Uncaria guianensis , en træagtig vin, der er hjemmehøre
Undersøgelsen sigter mod at øge antitumoral aktivitet af forbindelse ekstraheret fra en Amazon-pla…Uncaria guianensis, i flor, Cacuri, Venezuela. CC3.0 Forskere i Brasilien har udarbejdet modificerede former af alkaloiderne produceret af Uncaria guianensis , en træagtig vin, der er hjemmehøre -
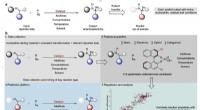 Forbedring af oddsene for syntetisk kemi succesProcessen til at udvikle prædiktive modeller for kemiske reaktioner. Kredit:Jolene Reid og Matthew Sigman. Kemi er mere end blot at blande forbindelse A med forbindelse B for at fremstille forbind
Forbedring af oddsene for syntetisk kemi succesProcessen til at udvikle prædiktive modeller for kemiske reaktioner. Kredit:Jolene Reid og Matthew Sigman. Kemi er mere end blot at blande forbindelse A med forbindelse B for at fremstille forbind -
 Molekyle egenskaber ændres gennem lysTobias Thomanek, Enrique Mendez Vega og Wolfram Sander (fra venstre). Ikke afbildet, men væsentligt involveret i undersøgelsen:Iris Trosien. Kredit:RUB, Marquard Inden for computerteknik, magnetis
Molekyle egenskaber ændres gennem lysTobias Thomanek, Enrique Mendez Vega og Wolfram Sander (fra venstre). Ikke afbildet, men væsentligt involveret i undersøgelsen:Iris Trosien. Kredit:RUB, Marquard Inden for computerteknik, magnetis -
 Cyanobakterier som grønne katalysatorer i bioteknologiCyanobakterier er miljøvenlige og let tilgængelige biokatalysatorer til produktion af nye kemikalier og, takket være forskere ved TU Graz, snart kunne bruges i store teknologiske applikationer. Kredit
Cyanobakterier som grønne katalysatorer i bioteknologiCyanobakterier er miljøvenlige og let tilgængelige biokatalysatorer til produktion af nye kemikalier og, takket være forskere ved TU Graz, snart kunne bruges i store teknologiske applikationer. Kredit


