Hvilken binding er AG-CL?
Her er hvorfor:
* Elektronegativitetsforskel: Sølv (Ag) har en elektronegativitet på 1,93, mens chlor (CL) har en elektronegativitet på 3,16. Denne store forskel i elektronegativitet (1,23) indikerer en stærk tendens til, at klor tiltrækker elektroner fra sølv.
* Elektronoverførsel: Som et resultat af denne elektronegativitetsforskel mister sølv et elektron for at blive en positivt ladet sølvion (Ag+), mens klor får et elektron for at blive en negativt ladet chloridion (CL-).
* Elektrostatisk attraktion: De modsatte ladede ioner tiltrækker derefter hinanden elektrostatisk og danner en ionisk binding.
Mens bindingen primært er ionisk, er der en lille grad af kovalent karakter på grund af polariseringen af elektronskyen. Dette betyder, at der er en lille mængde elektrondeling mellem sølv- og kloratomer, hvilket tilføjer den samlede bindingsstyrke.
Imidlertid er den ioniske karakter dominerende, og dermed betragtes bindingen i AG-CL primært ionisk.
 Varme artikler
Varme artikler
-
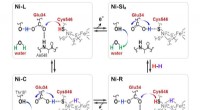 Mikroorganismer bygger de bedste brændstofeffektive brintcellerProtoner overføres mellem det aktive NiFe-sted og det omgivende protein gennem Cyt546- og Glu34-resterne under den katalytiske reaktion af [NiFe]-hydrogenase. Kredit:Shun Hirota For alle de fremsk
Mikroorganismer bygger de bedste brændstofeffektive brintcellerProtoner overføres mellem det aktive NiFe-sted og det omgivende protein gennem Cyt546- og Glu34-resterne under den katalytiske reaktion af [NiFe]-hydrogenase. Kredit:Shun Hirota For alle de fremsk -
 Bæredygtig transport:Rensning af luften på nitrogendopingAktive nitrogenatomer i kulstofkatalysatoren. Kredit:University of Tsukuba Proton-udvekslingsmembran (PEM) brændselsceller er en energilagringsteknologi, der vil hjælpe med at sænke transportens m
Bæredygtig transport:Rensning af luften på nitrogendopingAktive nitrogenatomer i kulstofkatalysatoren. Kredit:University of Tsukuba Proton-udvekslingsmembran (PEM) brændselsceller er en energilagringsteknologi, der vil hjælpe med at sænke transportens m -
 Strålende jernmolekyle kunne give billigere solenergiDet nye jernmolekyle. Kredit:Nils Rosemann For første gang, det er lykkedes for forskere at skabe et jernmolekyle, der både kan fungere som fotokatalysator til at producere brændstof og i solcelle
Strålende jernmolekyle kunne give billigere solenergiDet nye jernmolekyle. Kredit:Nils Rosemann For første gang, det er lykkedes for forskere at skabe et jernmolekyle, der både kan fungere som fotokatalysator til at producere brændstof og i solcelle -
 Kemiteknik er kædedrev for at skabe bedre syntetiske molekyler til medicinKredit:CC0 Public Domain I en undersøgelse med implikationer for fremtiden for lægemiddelopdagelse, Forskere fra Scripps Research viste, at de var i stand til at omdanne simple kemikalier til unik
Kemiteknik er kædedrev for at skabe bedre syntetiske molekyler til medicinKredit:CC0 Public Domain I en undersøgelse med implikationer for fremtiden for lægemiddelopdagelse, Forskere fra Scripps Research viste, at de var i stand til at omdanne simple kemikalier til unik
- Sådan beregnes din årlige gennemsnit på et rapportkort
- Hvor sikker er Nano? Nanotoksikologi:En tværfaglig udfordring
- Ingeniører undersøger, hvordan man kan forbedre højhastighedstogforbindelser mod frysning
- Hjælper aminosyrer os med at vokse?
- SwRIs lille satellitmission bevæger sig fremad
- Hvor stammer abiotiske ressourcer fra?


