Hvorfor er elektroner i den yderste skal vigtige?
* Kemisk binding: Valenselektroner er dem, der er involveret i dannelse af kemiske bindinger. De kan deles (kovalent binding) eller overføres (ionisk binding) med andre atomer for at opnå en stabil elektronkonfiguration.
* reaktivitet: Antallet af valenselektroner bestemmer et elements reaktivitet. Atomer med få valenselektroner har en tendens til at være meget reaktive, da de let får eller deler elektroner for at opnå en stabil konfiguration. Omvendt er atomer med en fuld ydre skal generelt ureaktive (ædelgasser).
* Fysiske egenskaber: Valenselektroner påvirker de fysiske egenskaber ved et stof som smeltepunkt, kogepunkt og ledningsevne.
* Kemiske egenskaber: Valenselektroner bestemmer et elements evne til at danne forskellige typer forbindelser og dets samlede opførsel i kemiske reaktioner.
i enklere termer:
Forestil dig den yderste skal som en atoms "sociale cirkel". Elektronerne i denne cirkel er dem, der interagerer med andre atomer 'sociale kredse. " Hvor mange venner de har, og hvordan de interagerer med andre bestemmer atomets personlighed og opførsel.
Her er nogle eksempler:
* natrium (NA) Har en valenselektron, hvilket gør det meget reaktivt, da den let mister dette elektron til at danne en positiv ion.
* klor (Cl) Har syv valenselektroner, hvilket gør det reaktivt, da det let får en elektron til at danne en negativ ion.
* helium (He) Har en fuld ydre skal med to valenselektroner, hvilket gør den ekstremt ureaktiv.
Forståelse af valenselektroner er afgørende for at forstå de grundlæggende principper for kemi, såsom hvordan elementer binder, danner forbindelser og reagerer med hinanden.
Sidste artikelHvad dannes, når to eller flere elementer kombineres?
Næste artikelHvad er organisk forurenende stof?
 Varme artikler
Varme artikler
-
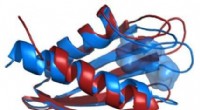 Røntgenøjne kigger dybere ind i dødbringende patogenSammenligning af strukturerne af Flpp3-proteinrygraden som afledt af en røntgenfri elektronlaser (rød) og fra NMR (blå) afslører et indre hulrum, der er unikt for NMR-strukturen og antyder derfor eksi
Røntgenøjne kigger dybere ind i dødbringende patogenSammenligning af strukturerne af Flpp3-proteinrygraden som afledt af en røntgenfri elektronlaser (rød) og fra NMR (blå) afslører et indre hulrum, der er unikt for NMR-strukturen og antyder derfor eksi -
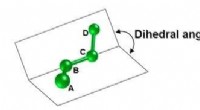 Fujitsu udvikler molekylær simuleringsteknologi til effektivt at skabe nye lægemiddelkandidaterFigur 1:Dihedral vinkel (vinklen dannet af planet skabt af atomer A, B, og C, og flyet skabt af atomer B, C, og D). Kredit:Fujitsu Fujitsu Laboratories annoncerede i dag udviklingen af molekylær
Fujitsu udvikler molekylær simuleringsteknologi til effektivt at skabe nye lægemiddelkandidaterFigur 1:Dihedral vinkel (vinklen dannet af planet skabt af atomer A, B, og C, og flyet skabt af atomer B, C, og D). Kredit:Fujitsu Fujitsu Laboratories annoncerede i dag udviklingen af molekylær -
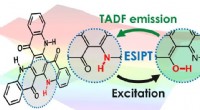 Udnyttelse af hoppende brinter til højeffektive OLED'erExcited-state intramolecular proton transfer (ESIPT) muliggør organiske lysemitterende dioder (OLEDer), der er yderst effektive ved at skabe de nødvendige betingelser for at muliggøre termisk aktivere
Udnyttelse af hoppende brinter til højeffektive OLED'erExcited-state intramolecular proton transfer (ESIPT) muliggør organiske lysemitterende dioder (OLEDer), der er yderst effektive ved at skabe de nødvendige betingelser for at muliggøre termisk aktivere -
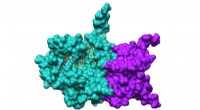 Forskere bruger Theta til analyse i realtid af COVID-19 proteinerNsp10/16 overflade med ligander. Forskere har udviklet en pipeline til at forbinde ALCF-supercomputere med APS-eksperimenter for at muliggøre analyse i realtid af COVID-19-proteiner, baner vejen for a
Forskere bruger Theta til analyse i realtid af COVID-19 proteinerNsp10/16 overflade med ligander. Forskere har udviklet en pipeline til at forbinde ALCF-supercomputere med APS-eksperimenter for at muliggøre analyse i realtid af COVID-19-proteiner, baner vejen for a
- Hvad sagde Niel Armstrong, da han landede på månen?
- Hvordan hjælper solenergi miljøet?
- Har stjerner af samme spektraltype karakteristika?
- Ny forskning viser, hvordan oprindeligt ejede virksomheder skaber bedre resultater for deres medarbe…
- Astronomer forklarer oprindelsen af undvigende ultradiffuse galakser
- Hvordan planternes frø tager form


