Hvad er kogepunktet for metaller og ikke-metaller?
* kogepunkter varierer meget inden for hver gruppe: Både metaller og ikke -metaller har et stort udvalg af kogepunkter afhængigt af det specifikke element.
* Metaller: Kviksølv er en væske ved stuetemperatur (kogepunkt 357 ° C), mens Wolfram har et af de højeste kogepunkter i alle elementer (5930 ° C).
* ikke -metaller: Helium koger ved -269 ° C (kun få grader over absolut nul), mens kulstof (i form af grafit) koger ved ca. 4827 ° C.
* kogepunkter påvirkes af faktorer som:
* atomstørrelse: Større atomer har generelt lavere kogepunkter på grund af svagere interatomiske kræfter.
* limningstype: Metallisk binding i metaller kan være stærk, hvilket fører til høje kogepunkter. Kovalent binding i ikke -metaller kan variere i styrke.
* struktur: Arrangementet af atomer inden for et fast stof kan påvirke kogepunktet.
I stedet for at tale om et enkelt kogepunkt, er det mere nøjagtigt at sige:
* Metaller har generelt højere kogepunkter end ikke -metaller. Dette skyldes, at metallisk binding generelt er stærkere end den kovalente binding, der findes i mange ikke -metaller.
* Der er undtagelser: Som nævnt ovenfor har nogle ikke -metaller som kulstof (i form af grafit) ekstremt høje kogepunkter.
Fortæl mig, hvis du gerne vil udforske kogepunkterne på specifikke metaller eller ikke -metaller!
Sidste artikelHvad er tempen for oxy-mapp gasflamme?
Næste artikelOpløses bordsalt i vand?
 Varme artikler
Varme artikler
-
 Triangle 2 plastbeholdere kan se miljømæssig makeoverKredit:ACS Genbrugelige plastbeholdere med nr. 2 -betegnelsen kan blive endnu mere populære for producenter som mælkekande af plast, opvaskemiddelbeholdere og shampoo -flasker kan snart få en milj
Triangle 2 plastbeholdere kan se miljømæssig makeoverKredit:ACS Genbrugelige plastbeholdere med nr. 2 -betegnelsen kan blive endnu mere populære for producenter som mælkekande af plast, opvaskemiddelbeholdere og shampoo -flasker kan snart få en milj -
 Brækker rumaffald nogensinde naturligt ned? (video)Kan du huske, da Elon Musk sendte en bil ud i rummet? Den bil driver ikke bare fredeligt gennem et vakuum – den suser rundt om solen med 63.592 miles i timen og bliver bombarderet af solstråling. Det
Brækker rumaffald nogensinde naturligt ned? (video)Kan du huske, da Elon Musk sendte en bil ud i rummet? Den bil driver ikke bare fredeligt gennem et vakuum – den suser rundt om solen med 63.592 miles i timen og bliver bombarderet af solstråling. Det -
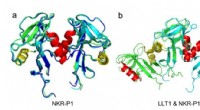 Fra atomet til naturlig dræbercelle:Historien om en uventet proteinstrukturStruktur af human NKR-P1, der viser den unikke dimeriseringsgrænseflade. Panel (a) sammenligner krystalstrukturer af NKR-P1-receptorbindende domæne-dimerer. Panel (b) viser en strukturel sammenligning
Fra atomet til naturlig dræbercelle:Historien om en uventet proteinstrukturStruktur af human NKR-P1, der viser den unikke dimeriseringsgrænseflade. Panel (a) sammenligner krystalstrukturer af NKR-P1-receptorbindende domæne-dimerer. Panel (b) viser en strukturel sammenligning -
 Svampeenzymer kan holde hemmeligheden bag fremstillingen af vedvarende energi fra træEn overordnet tredimensionel struktur af en af denne klasse af enzymer. Kredit:Professor Gideon Davies, University of York Et internationalt team af forskere, inklusive videnskabsmænd fra Univer
Svampeenzymer kan holde hemmeligheden bag fremstillingen af vedvarende energi fra træEn overordnet tredimensionel struktur af en af denne klasse af enzymer. Kredit:Professor Gideon Davies, University of York Et internationalt team af forskere, inklusive videnskabsmænd fra Univer
- Hvad hvis du rejste hurtigere end lysets hastighed?
- Forskere opdager hemmeligheden bag stabiliteten af kulstofisotoper
- HINODE fanger rekordstort solmagnetfelt
- Løsning af mysteriet om mørk energi:En ny opgave til et 45 år gammelt teleskop
- Hvad er kemisk ændring for bagepulver?
- NASA-satellitten giver et billede af en stor orkan Humberto


