Hvilket arrangement af elementer repræsenterer en stigende tendenselektronegativitet?
Forståelse af elektronegativitet
Elektronegativitet er et mål for et atoms evne til at tiltrække elektroner i en kemisk binding. Det øges:
* på tværs af en periode (venstre til højre): Når du bevæger dig over en periode, øges antallet af protoner i kernen, hvilket fører til en stærkere attraktion for elektroner.
* op en gruppe (top til bund): Elektroner i højere energiniveau er længere væk fra kernen og oplever mindre tiltrækning.
Eksempel arrangement
Her er et eksempel på elementer, der er arrangeret i stigende elektronegativitet:
* li
* være
* f> cl> br> i: Dette repræsenterer en trend -up -gruppe 17 (halogener).
Vigtig note: Elektronegativitet stiger generelt fra venstre mod højre og fra bund til top på det periodiske tabel. Der er dog undtagelser på grund af det komplekse samspil mellem forskellige faktorer.
 Varme artikler
Varme artikler
-
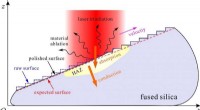 CO2 -laserablation fører en ny vej til skræddersyede kontinuerlige smeltede silicaoverfladerFigur 1. Skematisk diagram for 2-D numerisk model af CO 2 laserablation. Kredit:SIOM Smeltet silica er et vigtigt materiale til mange anvendelser inden for optik og fotonik på grund af dets frem
CO2 -laserablation fører en ny vej til skræddersyede kontinuerlige smeltede silicaoverfladerFigur 1. Skematisk diagram for 2-D numerisk model af CO 2 laserablation. Kredit:SIOM Smeltet silica er et vigtigt materiale til mange anvendelser inden for optik og fotonik på grund af dets frem -
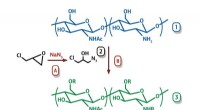 Kemikere får nyt materiale til antibakterielle madbelægningerRUDN University kemikere har udviklet en enkel og bekvem metode til fremstilling af derivater af den naturlige polymer chitosan. Disse derivater er ugiftige og har en udtalt antibakteriel aktivitet på
Kemikere får nyt materiale til antibakterielle madbelægningerRUDN University kemikere har udviklet en enkel og bekvem metode til fremstilling af derivater af den naturlige polymer chitosan. Disse derivater er ugiftige og har en udtalt antibakteriel aktivitet på -
 Fuglefjer inspirerer forskere til at producere levende nye farverBioinspireret lyst strukturelt farvet kolloidalt amorft array forstærket af styring af tykkelse og sort baggrund. Kredit:Yukikazu Takeoka Et forskergruppe ledet af Nagoya Universitet efterligner f
Fuglefjer inspirerer forskere til at producere levende nye farverBioinspireret lyst strukturelt farvet kolloidalt amorft array forstærket af styring af tykkelse og sort baggrund. Kredit:Yukikazu Takeoka Et forskergruppe ledet af Nagoya Universitet efterligner f -
 Undersøgelse baner vejen for oprettelse af tænd- og slukknapper til kemiske reaktionerVed at arbejde under ekstremt kontrollerede forhold, Eric Hudson og hans kolleger kunne observere egenskaber ved atomer og molekyler, der tidligere har været skjult for øje. Kredit:Stuart Wolpert/UCLA
Undersøgelse baner vejen for oprettelse af tænd- og slukknapper til kemiske reaktionerVed at arbejde under ekstremt kontrollerede forhold, Eric Hudson og hans kolleger kunne observere egenskaber ved atomer og molekyler, der tidligere har været skjult for øje. Kredit:Stuart Wolpert/UCLA
- Kan alger låse op for fotosyntesens hemmeligheder?
- Grafen og kobolt til at skabe nye elektromagnetiske enheder
- Nyt designværktøj til metamaterialer:Undersøgelse viser, hvordan man forudsiger ikke-lineære opt…
- Sætter mikroskopet på mediedækning for Stillehavsarbejdere
- Offshore vindkraft sæt til 15-dobling:IEA
- Undersøgelser finder, at politiske overbevisninger former den måde, offentligheden fortolker histo…


