Hvad ønsker kernen i et atom at gøre elektroner et nærliggende atom?
Her er en mere nøjagtig forklaring på, hvad der sker:
* Elektrostatisk attraktion: Den positivt ladede kerne af et atom tiltrækkes af de negativt ladede elektroner i et nærliggende atom. Denne attraktion er det, der holder atomer sammen i kemiske bindinger.
* Elektrondeling (kovalente obligationer): I nogle tilfælde deler atomer deres elektroner for at opnå en stabil konfiguration. Denne deling skaber en stærk binding mellem atomerne, som i vand (H2O), hvor brintatomerne deler elektroner med iltatomet.
* elektronoverførsel (ioniske bindinger): I andre tilfælde kan et atom fuldstændigt overføre et elektron til et andet atom. Dette skaber ioner (atomer med en positiv eller negativ ladning), der tiltrækkes af hinanden og danner en ionisk binding. Dette er som i bordsalt (NaCl), hvor natrium mister et elektron til klor.
Vigtig note: Mens kernen tiltrækker elektroner, "griber den faktisk ikke" eller "tager" elektroner fra andre atomer. Interaktionerne mellem atomer er meget mere komplekse og involverer en balance mellem kræfter, herunder frastødelse mellem kernerne og elektronerne inden for hvert atom.
Sidste artikelHvad er svagheder ved salt?
Næste artikelHvilket arrangement af elementer repræsenterer en stigende tendenselektronegativitet?
 Varme artikler
Varme artikler
-
 Forskere foreslår strategi for katalytisk regiodivergerende hydrosilylering af isoprenKredit:CC0 Public Domain Kontrol af regioselektiviteten har været et grundlæggende problem i organisk syntese på grund af den mulige dannelse af et sæt regioisomerer i kemiske reaktioner. Organos
Forskere foreslår strategi for katalytisk regiodivergerende hydrosilylering af isoprenKredit:CC0 Public Domain Kontrol af regioselektiviteten har været et grundlæggende problem i organisk syntese på grund af den mulige dannelse af et sæt regioisomerer i kemiske reaktioner. Organos -
 Kemikere skaber nyt kunstigt enzymVed hjælp af beregningskemi, kandidatstuderende Vindi M. Jayasinghe-Arachchige og Rajeev Prabhakar, professor i kemi, designet et nyt molekyle, der betydeligt kunne fremme undersøgelsen og anvendelsen
Kemikere skaber nyt kunstigt enzymVed hjælp af beregningskemi, kandidatstuderende Vindi M. Jayasinghe-Arachchige og Rajeev Prabhakar, professor i kemi, designet et nyt molekyle, der betydeligt kunne fremme undersøgelsen og anvendelsen -
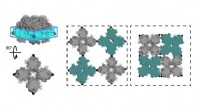 Supercomputer fremkomsten af materiel adfærdKemikere ved University of California, San Diego (UCSD) designet et ark proteiner (C98RhuA), der skifter mellem forskellige porøsitetstilstande og densitet. Cellerne i krystalgitteret er hængslet i hj
Supercomputer fremkomsten af materiel adfærdKemikere ved University of California, San Diego (UCSD) designet et ark proteiner (C98RhuA), der skifter mellem forskellige porøsitetstilstande og densitet. Cellerne i krystalgitteret er hængslet i hj -
 Udnyttelse af solen til at bringe frisk vand til fjerntliggende eller katastroferamte samfundKredit:CC0 Public Domain En enhed, der tager en ny tilgang til at fjerne salt fra vand, er blevet udviklet i Bath, baner vejen for små, solcelledrevne afsaltningsenheder Forskere ved University o
Udnyttelse af solen til at bringe frisk vand til fjerntliggende eller katastroferamte samfundKredit:CC0 Public Domain En enhed, der tager en ny tilgang til at fjerne salt fra vand, er blevet udviklet i Bath, baner vejen for små, solcelledrevne afsaltningsenheder Forskere ved University o


