Hvordan afhenter et element ekstra elektroner eller tab for at danne ioner?
Det grundlæggende
* atomer: De grundlæggende byggesten til stof, sammensat af protoner, neutroner og elektroner.
* Protoner: Positivt ladede partikler i atomets kerne.
* neutroner: Neutralt ladede partikler i atomets kerne.
* Elektroner: Negativt ladede partikler, der kredser om kernen i skaller.
* ioner: Atomer, der har opnået eller mistet elektroner, hvilket resulterer i en nettopositiv eller negativ ladning.
hvordan elementer danner ioner
Atomer stræber efter at opnå en stabil konfiguration, typisk med en fuld yderste elektronskal (også kaldet Valence Shell). Dette kaldes ofte "Octet -reglen", hvilket betyder, at atomer har en tendens til at vinde, miste eller dele elektroner for at have otte elektroner i deres yderste skal.
At vinde elektroner (anioner)
* ikke -metaller: Ikke -metaller har generelt en høj elektronegativitet, hvilket betyder, at de har en stærk attraktion for elektroner.
* proces: For at opnå en stabil konfiguration har ikke -metaller en tendens til at vinde elektroner.
* Resultat: Ved at vinde elektroner bliver de negativt ladede ioner kaldet anioner. For eksempel får chlor (CL) et elektron til at blive chlorid (CL⁻).
taber elektroner (kationer)
* Metaller: Metaller har generelt en lav elektronegativitet, hvilket betyder, at de er mere tilbøjelige til at miste elektroner.
* proces: For at opnå en stabil konfiguration har metaller en tendens til at miste elektroner.
* Resultat: Ved at miste elektroner bliver de positivt ladede ioner kaldet kationer. For eksempel mister natrium (Na) et elektron for at blive natriumion (Na⁺).
Faktorer, der påvirker iondannelse
* Elektronegativitet: En atoms relative evne til at tiltrække elektroner. Større elektronegativitet favoriserer at vinde elektroner, mens lavere elektronegativitet favoriserer at miste elektroner.
* ioniseringsenergi: Den energi, der kræves for at fjerne et elektron fra et atom. Nedre ioniseringsenergi gør det lettere at miste elektroner.
* Elektronaffinitet: Energiændringen, der opstår, når et elektron tilsættes til et neutralt atom. Højere elektronaffinitet gør det mere sandsynligt, at det får elektroner.
Eksempler
* natrium (NA) danner NA⁺: Natrium har en elektron i sin yderste skal. Det mister dette elektron for at blive stabil og danne en kation med en +1 ladning.
* klor (CL) danner cl⁻: Klor har syv elektroner i sin yderste skal. Det får en elektron for at afslutte sin oktet og danne en anion med en -1 -ladning.
Nøglepunkter
* Iondannelse drives af ønsket om at opnå en stabil elektronkonfiguration.
* Elementer med lav ioniseringsenergi har en tendens til at danne kationer.
* Elementer med høj elektronegativitet har en tendens til at danne anioner.
* Ioner spiller afgørende roller i kemisk binding og danner ioniske forbindelser.
Sidste artikelHvad er 10Stone10ibs i kilo?
Næste artikelTo elektroner i helium er kun placeret en skal, mens tre lithium optager to skaller?
 Varme artikler
Varme artikler
-
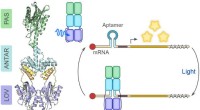 Blåt lys til RNA -kontrolFotoreceptoren PAL binder korte ribonukleinsyrer ved bestråling af blåt lys. Denne lysstyrede aktivitet kan bruges til at regulere RNA-baserede processer, såsom translation. Kredit:© Andreas Möglich/U
Blåt lys til RNA -kontrolFotoreceptoren PAL binder korte ribonukleinsyrer ved bestråling af blåt lys. Denne lysstyrede aktivitet kan bruges til at regulere RNA-baserede processer, såsom translation. Kredit:© Andreas Möglich/U -
 Er emballage af gurkemeje film fremtiden for supermarkedernes hylder?Kredit:pinkomelet/123rf Forskere i Malaysia har udviklet en biopolymerfilm, der indeholder gurkemejeolie, der stopper væksten af en almindelig madsvamp og nedbrydes godt i jorden. Filmen kan giv
Er emballage af gurkemeje film fremtiden for supermarkedernes hylder?Kredit:pinkomelet/123rf Forskere i Malaysia har udviklet en biopolymerfilm, der indeholder gurkemejeolie, der stopper væksten af en almindelig madsvamp og nedbrydes godt i jorden. Filmen kan giv -
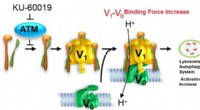 Forskere rapporterer hæmning af cellulær aldringOpdag nøglen til at afsløre hemmeligheden bag reversibel aldringsopsving. Kredit:DGIST Aldring er en forringelse af en celles evne til at dele sig og vokse, når den bliver ældre. Dette forårsager
Forskere rapporterer hæmning af cellulær aldringOpdag nøglen til at afsløre hemmeligheden bag reversibel aldringsopsving. Kredit:DGIST Aldring er en forringelse af en celles evne til at dele sig og vokse, når den bliver ældre. Dette forårsager -
 Forskere gør grøn kemi frem med ny katalysator til reduktion af kuldioxidKredit:CC0 Public Domain Forskere ved Oregon State University har gjort et vigtigt fremskridt i den grønne kemi stræben efter at omdanne drivhusgassen kuldioxid til genanvendelige former for kulst
Forskere gør grøn kemi frem med ny katalysator til reduktion af kuldioxidKredit:CC0 Public Domain Forskere ved Oregon State University har gjort et vigtigt fremskridt i den grønne kemi stræben efter at omdanne drivhusgassen kuldioxid til genanvendelige former for kulst
- Hvad sker der, når kaliumiodid og blynitrat kombineres?
- Lyser på, hvordan bakterier interagerer
- Konstruerede defekter i krystallinsk materiale øger den elektriske ydeevne
- Hvad er forskellen i betydningen mellem tilpasning og naturligt valg?
- Magnetiske pindsvin kunne lagre store data på et lille rum
- Virkningen af COVID-19 har skabt store uoverensstemmelser i elevernes erfaringer med at tage A-niv…


