Hvad er de intermolekylære kræfter involveret i CH3OH?
* Hydrogenbinding: Dette er den stærkeste intermolekylære kraft, der er til stede i methanol. Hydrogenatomet bundet til det stærkt elektronegative iltatom (O-H) skaber et dipolmoment, hvilket muliggør stærk hydrogenbinding mellem iltatomet i et methanolmolekyle og hydrogenatomet af en anden.
* dipol-dipolinteraktioner: Den polære O-H-binding i methanol resulterer i et permanent dipolmoment over molekylet. Disse dipoler interagerer med hinanden og skaber dipol-dipol-kræfter.
* London Dispersion Forces: Dette er de svageste intermolekylære kræfter, der er til stede i alle molekyler, inklusive methanol. De stammer fra midlertidige udsving i elektronfordeling og skaber midlertidige dipoler, der inducerer dipoler i nabolande molekyler.
generelt: Hydrogenbinding er den dominerende intermolekylære kraft i methanol, hvilket giver den et relativt højt kogepunkt sammenlignet med andre molekyler med lignende molekylvægt.
 Varme artikler
Varme artikler
-
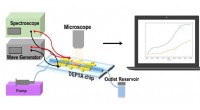 Forskere udvikler et laboratorium på en chip til personlig overvågning af lægemiddeleffektivitetKredit:University of California, Irvine UCI forskere og samarbejdspartnere har udviklet en lab on a chip platform for at lette kontinuerlige, billig, hurtig og personlig lægemiddelscreening. Tekno
Forskere udvikler et laboratorium på en chip til personlig overvågning af lægemiddeleffektivitetKredit:University of California, Irvine UCI forskere og samarbejdspartnere har udviklet en lab on a chip platform for at lette kontinuerlige, billig, hurtig og personlig lægemiddelscreening. Tekno -
 Forskere udvikler 3-D printsubstrat med dynamiske bindinger til justerbare egenskaber4-D-print:En farve- og formskiftende blomst i mikrostørrelse skabt ved direkte laserskrivning. Kredit:TU/e Fantastiske former kan laves ved hjælp af 3-D print, men til mange applikationer skal det
Forskere udvikler 3-D printsubstrat med dynamiske bindinger til justerbare egenskaber4-D-print:En farve- og formskiftende blomst i mikrostørrelse skabt ved direkte laserskrivning. Kredit:TU/e Fantastiske former kan laves ved hjælp af 3-D print, men til mange applikationer skal det -
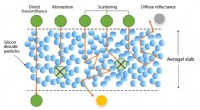 Aerogeler til solcelleanlæg og vinduerFigur 1:Noget indfaldende lys absorberes i aerogelen eller passerer lige igennem og kommer ud fra den anden side - mærket ovenfor som direkte transmittans. Resten kan omdirigeres hver gang den støder
Aerogeler til solcelleanlæg og vinduerFigur 1:Noget indfaldende lys absorberes i aerogelen eller passerer lige igennem og kommer ud fra den anden side - mærket ovenfor som direkte transmittans. Resten kan omdirigeres hver gang den støder -
 Sådan bukker du fladt glas perfekt rundt om hjørnerEt dobbeltglas hjørneelement produceret med den nye glasbukkeproces. Kredit:Fraunhofer IWM Forskere fra Fraunhofer Institute for Mechanics of Materials IWM har udviklet en ny proces, der kan bøje
Sådan bukker du fladt glas perfekt rundt om hjørnerEt dobbeltglas hjørneelement produceret med den nye glasbukkeproces. Kredit:Fraunhofer IWM Forskere fra Fraunhofer Institute for Mechanics of Materials IWM har udviklet en ny proces, der kan bøje
- Hvordan et vendt gen hjalp sommerfugle med at udvikle mimik
- Kan Tesla -prisnedsættelser betyde, at efterspørgslen aftager?
- Kunstig intelligens møder materialevidenskab
- Hvad er en biocenose?
- Hvilke typer energi får du, når du brænder brændstof?
- Store luftfartsselskaber, statens AG'er vil arbejde for at bekæmpe robocalls


