Hvad er ting, der mindsker en reaktionshastighed?
1. Sænkningstemperatur:
* kinetisk energi: Reaktioner opstår, når molekyler kolliderer med nok energi til at bryde bindinger og danne nye. Sænkning af temperaturen reducerer den gennemsnitlige kinetiske energi af molekyler, hvilket fører til færre succesrige kollisioner.
* Aktiveringsenergi: Hver reaktion har en aktiveringsenergibarriere, som molekyler skal overvinde for at reagere. Lavere temperaturer gør det sværere for molekyler at nå dette energiniveau.
2. Faldende koncentration af reaktanter:
* Kollisionsfrekvens: Højere reaktantkoncentrationer betyder, at flere molekyler er til stede, hvilket øger chancen for kollisioner mellem reaktantmolekyler. Sænkning af koncentrationer reducerer kollisionsfrekvensen, hvilket bremser reaktionen.
3. Stigende aktiveringsenergi:
* Aktiveringsenergibarriere: Aktiveringsenergien er den minimale energi, der kræves for at en reaktion kan forekomme. Forøgelse af aktiveringsenergibarriere gør det sværere for molekyler at nå det nødvendige energiniveau og bremse reaktionen. Dette kan være forårsaget af:
* Introduktion af en katalysator, der bremser reaktionen (en negativ katalysator).
* Ændring af reaktionsmediet (f.eks. Ved hjælp af et andet opløsningsmiddel).
4. Stigende overfladeareal:
* heterogene reaktioner: Reaktioner, der involverer stoffer i forskellige faser (f.eks. Fast og flydende), påvirkes af overfladeareal. Et større overfladeareal giver flere kontaktpunkter for reaktanterne og øger reaktionshastigheden. Imidlertid reducerer faldende overfladeareal kontaktpunkter, hvilket bremser reaktionen.
5. Tilføjelse af en katalysator, der bremser reaktionen:
* katalysatorer: Mens de fleste katalysatorer fremskynder reaktioner, er der nogle, der kan fungere som negative katalysatorer og bremse reaktioner. Disse katalysatorer øger aktiveringsenergien, hvilket gør det sværere for reaktionen at forekomme.
6. Ændring af reaktanters fase:
* reaktionshastigheder i forskellige faser: Reaktioner har en tendens til at være hurtigere i gasfasen sammenlignet med den flydende fase og endnu langsommere i den faste fase. Dette skyldes den øgede frihedsfrihed og kollisionsfrekvens i gasser.
7. Forøgelse af det delvise tryk af inerte gasser:
* Kollisionsfrekvens: I en gasblanding reducerer tilsætning af inerte gasser det delvise tryk af reaktanter, hvilket fører til færre kollisioner mellem reaktantmolekyler og reducerer reaktionshastigheden.
8. Tilføjelse af et produkt til reaktionsblandingen:
* le Chateliers princip: I henhold til Le Chateliers princip skifter et produkt til en reaktionsblanding ligevægten mod reaktanterne og bremser den fremadgående reaktion.
Eksempel:
Forestil dig et lejrbål. Tilsætning af mere træ (stigende koncentration) og blæser på ilden (stigende temperatur) vil få den til at brænde hurtigere. Omvendt vil dække ilden med aske (faldende overfladeareal) og bruge vådt træ (sænkningstemperatur) bremse brændende proces.
Sidste artikelHvorfor er alkalimetaller mere reaktive end overgangsmetaller?
Næste artikelEt sæt af 8 valenselektroner kaldes?
 Varme artikler
Varme artikler
-
 Fotokatalytiske nanofibre udviklet til brug i effektiv brintproduktionKredit:CC0 Public Domain Et team af forskere fra Storbritannien, Canada og Hong Kong har udviklet fotokatalytiske nanofibre, der kan bruges til effektiv produktion af brint. I deres papir offentli
Fotokatalytiske nanofibre udviklet til brug i effektiv brintproduktionKredit:CC0 Public Domain Et team af forskere fra Storbritannien, Canada og Hong Kong har udviklet fotokatalytiske nanofibre, der kan bruges til effektiv produktion af brint. I deres papir offentli -
 Hvordan man udvider og kontraherer buede overflader af alle formerForskere ved TU Delfts afdeling for Precision and Microsystems Engineering (PME) har designet en dilatationsmetode, som kan anvendes på enhver buet overflade. Denne universelle metode kan have en rækk
Hvordan man udvider og kontraherer buede overflader af alle formerForskere ved TU Delfts afdeling for Precision and Microsystems Engineering (PME) har designet en dilatationsmetode, som kan anvendes på enhver buet overflade. Denne universelle metode kan have en rækk -
 Forskere kommer op med en hurtigere måde at opdage antibiotika påKredit:Elena Khavina/MIPT Pressekontor Russiske biokemikere har identificeret en lovende ny klasse af antibiotika. Efter at have studeret over 125, 000 molekyler, de fandt, at 2-pyrazol-1-yl-thiaz
Forskere kommer op med en hurtigere måde at opdage antibiotika påKredit:Elena Khavina/MIPT Pressekontor Russiske biokemikere har identificeret en lovende ny klasse af antibiotika. Efter at have studeret over 125, 000 molekyler, de fandt, at 2-pyrazol-1-yl-thiaz -
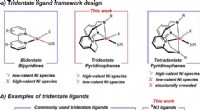 Nyt molekyle sætter scenen for nikkel som en grønnere fotokatalysator, afslører vigtige trin i re…et Tridentate ligandrammedesign. b Repræsentative tridentate N-donorligander, der almindeligvis anvendes til at stabilisere ualmindelige Ni-oxidationstilstande og RN3 tridentate ligander udviklet i de
Nyt molekyle sætter scenen for nikkel som en grønnere fotokatalysator, afslører vigtige trin i re…et Tridentate ligandrammedesign. b Repræsentative tridentate N-donorligander, der almindeligvis anvendes til at stabilisere ualmindelige Ni-oxidationstilstande og RN3 tridentate ligander udviklet i de
- Stillegående British Columbia-forkastning, der er i stand til at producere store jordskælv
- Hvad er et kendetegn ved bakterier, som nøglen til at holde dem under kontrol?
- Hvilken nettokraft er den udvidede tredimensionelle krystalstruktur af et salt, såsom natriumchlori…
- Hvis du ser på etiketten på en flaske syre, hvordan kan du se, er koncentreret eller ej?
- Kritikere, der siger, at onlinespil bare er et spil, går fuldstændig glip af pointen
- Hvad er St Kilda Archipelago?


