Hvorfor får eller mister et element elektroner for at blive ion?
* octet regel: Atomer er mest stabile, når de har en fuld ydre skal af elektroner. For de fleste elementer betyder det at have otte elektroner i deres yderste energiniveau (valensskallen).
* ædle gaskonfiguration: Ædle gasser er de mest stabile elementer i den periodiske tabel, fordi de har en fuld ydre skal af elektroner. Atomer forsøger at opnå denne samme stabile konfiguration.
* ionisk binding: Når et atom får eller mister elektroner, bliver det en ion. Ioner med modsatte afgifter (en positiv, en negativ) tiltrækker hinanden og danner ioniske bindinger. Denne attraktion er drivkraften bag dannelsen af mange ioniske forbindelser.
Her er en sammenbrud af, hvordan det fungerer:
* Metaller: Metaller har en tendens til at tabe Elektroner til dannelse af positivt ladede ioner (kationer). De ønsker at slippe af med deres ydre elektroner for at opnå en mere stabil konfiguration.
* ikke -metaller: Ikke -metaller har en tendens til at vinde Elektroner til dannelse af negativt ladede ioner (anioner). De vil fylde deres ydre skal for at opnå en stabil konfiguration.
Eksempel:
* natrium (NA): Natrium har en elektron i sin ydre skal. Ved at miste denne elektron bliver det en natriumion (Na+) med en fuld ydre skal (som neon).
* klor (Cl): Klor har syv elektroner i sin ydre skal. Ved at vinde en elektron bliver det en chloridion (Cl-) med en fuld ydre skal (som argon).
Kortfattet:
Elementer får eller mister elektroner for at blive ioner, fordi det giver dem mulighed for at opnå en mere stabil elektronkonfiguration, der efterligner de ædle gasser. Denne stabilitet skyldes octetreglen, der siger, at atomer er mest stabile med en fuld ydre skal af otte elektroner.
Sidste artikelHvad skal et svovlatom blive en ion?
Næste artikelHvad griber ind i ozonlaget?
 Varme artikler
Varme artikler
-
 Brintøkonomi med masseproduktion af højrent brint fra ammoniakAmmoniakbaseret brintekstraktionsanordning. Kredit:Korea Institute of Science and Technology (KIST) Korea Institute of Science and Technology (KIST) har udsendt en meddelelse om teknologien til at
Brintøkonomi med masseproduktion af højrent brint fra ammoniakAmmoniakbaseret brintekstraktionsanordning. Kredit:Korea Institute of Science and Technology (KIST) Korea Institute of Science and Technology (KIST) har udsendt en meddelelse om teknologien til at -
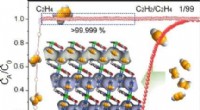 Adskillelse af sporacetylen fra ethylen i ultramikroporøse metal-organiske rammerKredit:Angewandte Chemie Ethylen, en vigtig råvare i den kemiske industri, indeholder ofte spor af acetylenforureninger, som skal fjernes. I journalen Angewandte Chemie , forskere beskriver en r
Adskillelse af sporacetylen fra ethylen i ultramikroporøse metal-organiske rammerKredit:Angewandte Chemie Ethylen, en vigtig råvare i den kemiske industri, indeholder ofte spor af acetylenforureninger, som skal fjernes. I journalen Angewandte Chemie , forskere beskriver en r -
 Niobium bruges som katalysator i brændselscellerGlycerol brændselscelle kan erstatte batterier i mobiltelefoner og bærbare computere, og kan i fremtiden bruges til at køre elbiler og levere strøm til hjem (niobium krystaller. Kredit:Artem Topchiy /
Niobium bruges som katalysator i brændselscellerGlycerol brændselscelle kan erstatte batterier i mobiltelefoner og bærbare computere, og kan i fremtiden bruges til at køre elbiler og levere strøm til hjem (niobium krystaller. Kredit:Artem Topchiy / -
 Brug af kitin, et bioinspireret materiale, at fremstille værktøj og shelters på MarsEt billede af en marsboer. Kredit:Javier G. Fernandez, 2020. CC-BY En simpel fremstillingsteknologi baseret på kitin, en af de mest allestedsnærværende organiske polymerer på jorden, kunne bruge
Brug af kitin, et bioinspireret materiale, at fremstille værktøj og shelters på MarsEt billede af en marsboer. Kredit:Javier G. Fernandez, 2020. CC-BY En simpel fremstillingsteknologi baseret på kitin, en af de mest allestedsnærværende organiske polymerer på jorden, kunne bruge
- Sådan konverteres atomer til gram med en lommeregner
- Historiker viser millioner af flyttede gravsteder i Kina i nye, interaktiv hjemmeside
- Onlineværktøj designet til at beregne ejendomsenergieffektivitet
- Afdækning af Temperance Betydning Tarot-kort
- Hvordan Usain Bolt kan løbe hurtigere -- ubesværet
- Hvorfor betaler forbrugerne mere? Forskning finder den overraskende effekt af forbrugernes lokale id…


