Hvornår fordamper et stof?
* Intermolekylære kræfter: Dette er de attraktive kræfter mellem molekyler, som hydrogenbinding, dipol-dipol-interaktioner og London-spredningskræfter. De holder molekyler sammen i en væske.
* kinetisk energi: Molekyler bevæger sig konstant og vibrerer. Jo varmere et stof er, jo hurtigere bevæger dens molekyler sig, og jo mere kinetisk energi har de.
* Fordampning: Når et molekyle på overfladen af en væske får nok kinetisk energi, kan det overvinde de intermolekylære kræfter, der holder den til væsken. Det bryder derefter fri og går ind i gasfasen.
Faktorer, der påvirker fordampning:
* Temperatur: Højere temperaturer betyder mere kinetisk energi, hvilket gør fordampning hurtigere.
* overfladeareal: Et større overfladeareal udsætter flere molekyler for luften og øger fordampningshastigheden.
* luftbevægelse: Bevægelse af luft bærer væk fordampede molekyler, hvilket reducerer koncentrationen af gasmolekyler over væsken og tilskynder til yderligere fordampning.
* Type stof: Forskellige stoffer har forskellige intermolekylære kræfter, der påvirker deres fordampningshastighed. Stoffer med svage intermolekylære kræfter fordamper lettere.
Kortfattet: Fordampning er en kontinuerlig proces, hvor molekyler får nok energi til at flygte fra flydende tilstand og blive en gas. Denne proces er påvirket af flere faktorer, herunder temperatur, overfladeareal, luftbevægelse og arten af selve stoffet.
 Varme artikler
Varme artikler
-
 Flyveaske geopolymerbeton:Betydeligt forbedret modstandsdygtighed over for ekstremt alkaliangrebGeopolymer betonblokke, varmehærdet ved 200 grader Celsius og derefter nedsænket i et ekstremt alkalisk medium i 14 dage ved 80 grader Celsius (a og b), modstå angrebet væsentligt bedre end blokke var
Flyveaske geopolymerbeton:Betydeligt forbedret modstandsdygtighed over for ekstremt alkaliangrebGeopolymer betonblokke, varmehærdet ved 200 grader Celsius og derefter nedsænket i et ekstremt alkalisk medium i 14 dage ved 80 grader Celsius (a og b), modstå angrebet væsentligt bedre end blokke var -
 SmartFarm-enhed høster luftfugtighed for autonom, selvbærende bylandbrugKredit:National University of Singapore Et team af forskere fra National University of Singapore (NUS) har for nylig udviklet en simpel løsning til at løse to af verdens største problemer - vandkn
SmartFarm-enhed høster luftfugtighed for autonom, selvbærende bylandbrugKredit:National University of Singapore Et team af forskere fra National University of Singapore (NUS) har for nylig udviklet en simpel løsning til at løse to af verdens største problemer - vandkn -
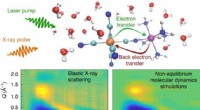 Forskere får indsigt i, hvordan opløsningsmiddelmolekyler påvirker lysdrevne reaktionerAbstrakt. Kredit: Naturkemi (2021). DOI:10.1038/s41557-020-00629-3 Lysabsorberende molekyler kan omdanne fotoner til elektricitet eller brændstoffer ved at skifte elektroner fra et atom til et an
Forskere får indsigt i, hvordan opløsningsmiddelmolekyler påvirker lysdrevne reaktionerAbstrakt. Kredit: Naturkemi (2021). DOI:10.1038/s41557-020-00629-3 Lysabsorberende molekyler kan omdanne fotoner til elektricitet eller brændstoffer ved at skifte elektroner fra et atom til et an -
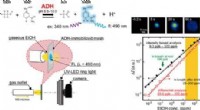 Sniff-cam for at opdage sygdomKredit:American Chemical Society At have dårlig ånde kan betyde, at nogen spiste en ildelugtende frokost, men det kan indikere, at personen er syg. Forskellige duftforbindelser er blevet forbundet
Sniff-cam for at opdage sygdomKredit:American Chemical Society At have dårlig ånde kan betyde, at nogen spiste en ildelugtende frokost, men det kan indikere, at personen er syg. Forskellige duftforbindelser er blevet forbundet
- Hvilken naturressource bores efter i Irak?
- Protein udnytter kraften i dumme gåture
- Hvad forårsager en eksoterm reaktion med Alka Seltzer?
- Enkel forklaring af elektromagneter
- Forskere udvikler en bæredygtig metode til at udvinde vanillin fra træforarbejdningsaffald
- NASA-flyvninger opdager millioner af arktiske metan-hotspots


