Hvordan kan forskellige former for en solid have klarheder som grafit og diamant?
Her er en sammenbrud:
* Både grafit og diamant er udelukkende lavet af carbonatomer. Dette er deres eneste almindelighed på atomniveau.
* krystalstruktur er nøglen: Arrangementet af disse carbonatomer inden for det faste stof er det, der bestemmer deres meget forskellige egenskaber.
* grafit: I grafit er carbonatomer arrangeret i flade ark, der danner hexagonale ringe som honningkage. Disse ark holdes svagt sammen af van der Waals -styrker. Denne svage binding gør det muligt for arkene at glide let over hinanden, hvilket gør grafit blød og glat, perfekt til blyantleder.
* diamant: I diamant er hvert carbonatom bundet til fire andre carbonatomer i en stærk, tredimensionel tetrahedral struktur. Dette skaber et meget stift, hårdt og gennemsigtigt materiale, hvilket gør det velegnet til smykker og industrielle værktøjer.
for at opsummere:
* grafit: Blød, glat, uigennemsigtig, god leder af elektricitet
* diamant: Hård, gennemsigtig, dårlig leder af elektricitet
Andre eksempler:
* Elementær svovl: Det findes i forskellige former som rhombisk svovl (gul, sprødt) og monoklinisk svovl (nållignende krystaller).
* jern: Jern kan eksistere som kropscentreret kubisk (BCC) og ansigt-centrerede kubiske (FCC) strukturer, hver med forskellige egenskaber.
Konklusion: Selvom atomerne i sig selv er de samme, definerer og bundet i en solid, hvordan atomer er arrangeret og bundet inden for en solid og kemiske egenskaber. Det er som at have de samme byggesten, men bygge helt forskellige strukturer!
 Varme artikler
Varme artikler
-
 Udpegning af biomolekyler med nanometer nøjagtighedNanometer nøjagtighed i fjernfelts fluorescenslokaliseringsmikroskopi af to fluoroforer bundet til begge ender af 30 basepar af et dobbeltstrenget DNA (dsDNA) molekyle blev demonstreret ved at bruge k
Udpegning af biomolekyler med nanometer nøjagtighedNanometer nøjagtighed i fjernfelts fluorescenslokaliseringsmikroskopi af to fluoroforer bundet til begge ender af 30 basepar af et dobbeltstrenget DNA (dsDNA) molekyle blev demonstreret ved at bruge k -
 Nedbrydelige belægninger til komposterbar papiremballage til fødevarer blokerer fedt og olieKredit:Unsplash/CC0 Public Domain Kopper, kartoner og madindpakninger lavet af papir kan virke som om de ville være biologisk nedbrydelige, men mange indeholder en plastbelægning, der ikke kan kom
Nedbrydelige belægninger til komposterbar papiremballage til fødevarer blokerer fedt og olieKredit:Unsplash/CC0 Public Domain Kopper, kartoner og madindpakninger lavet af papir kan virke som om de ville være biologisk nedbrydelige, men mange indeholder en plastbelægning, der ikke kan kom -
 Edderkoppesilke:Et formbart protein giver forstærkningFiguren viser et edderkoppespind sammen med den undersøgte domænes molekylære struktur i bunden tilstand i overfladerepræsentation (struktur i rød/orange, øverste venstre hjørne). Aminosyrens methioni
Edderkoppesilke:Et formbart protein giver forstærkningFiguren viser et edderkoppespind sammen med den undersøgte domænes molekylære struktur i bunden tilstand i overfladerepræsentation (struktur i rød/orange, øverste venstre hjørne). Aminosyrens methioni -
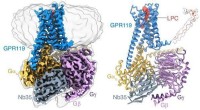 Undersøgelse afslører ligandgenkendelsesmekanisme for forældreløs receptor GPR119Identifikation af LPCet bundet til GPR119-Gs-komplekset ved hjælp af cryo-EM. Kredit:Peiyu Xu fra H. Eric Xus laboratorium Metaboliske sygdomme, herunder diabetes, fedtlever og fedme, er blevet en
Undersøgelse afslører ligandgenkendelsesmekanisme for forældreløs receptor GPR119Identifikation af LPCet bundet til GPR119-Gs-komplekset ved hjælp af cryo-EM. Kredit:Peiyu Xu fra H. Eric Xus laboratorium Metaboliske sygdomme, herunder diabetes, fedtlever og fedme, er blevet en
- Vorticitet regulerer bølger i væsker
- Strømafbrydelse:Ingeniører skaber en trådløs oplader, som du nemt kan skære i form
- Udvides eller samles vand, når det opvarmes?
- Frygten vokser på digital overvågning:amerikansk undersøgelse
- Hvordan har NASA forbedret tv -teknologien?
- Team opnår lysforstærkning med elektrisk stimulerede kvanteprikker


