Hvorfor er CU mere reaktiv end Zn?
* Elektronkonfiguration: Zink har en elektronkonfiguration af [AR] 3D¹⁰ 4S², mens kobber har en elektronkonfiguration af [AR] 3D¹⁰ 4S¹. Dette betyder, at zink har to valenselektroner i sin yderste skal, hvilket gør det lettere at miste dem og danne positive ioner. Kobber, med kun en valenselektron, kræver mere energi for at miste en elektron.
* Elektrokemisk serie: Den elektrokemiske serie rangerer metaller baseret på deres tendens til at miste elektroner og danne kationer. Zink har et mere negativt standardelektrodepotentiale (-0,76 V) sammenlignet med kobber (+0,34 V). Dette indikerer, at zink har en større tendens til at miste elektroner og derfor er mere reaktiv.
Praktisk eksempel:
* Hvis du lægger et stykke zinkmetal i en opløsning af kobbersulfat, fortrænger zink kobberionerne fra opløsningen, danner zinksulfat og afsætter kobbermetal på zinkoverfladen. Dette er en klar demonstration af zinks højere reaktivitet.
Kortfattet:
Zinks større reaktivitet stammer fra dens elektronkonfiguration, som giver den mulighed for let at miste elektroner og dets mere negative standardelektrodepotentiale, hvilket indikerer en stærkere tendens til at danne positive ioner.
Sidste artikelHvorfor er Hardy-Weinberg-ligevægt?
Næste artikelHvad er densiteten af gneis?
 Varme artikler
Varme artikler
-
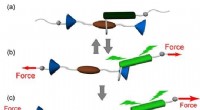 Nysgerrige sammenlåste molekyler viser dobbelt responsFigur 1. Skematisk illustration af driften af en rotaxan-baseret mekanophor, viser (a) kraftfri tilstand, (b) reversibel, og (c) irreversible svar. Forskere udforskede en mærkelig sammenkoblet molek
Nysgerrige sammenlåste molekyler viser dobbelt responsFigur 1. Skematisk illustration af driften af en rotaxan-baseret mekanophor, viser (a) kraftfri tilstand, (b) reversibel, og (c) irreversible svar. Forskere udforskede en mærkelig sammenkoblet molek -
 Visualisering af hvert trin i cycloaddition-reaktioner på overfladenScanning af tunnelmikroskopibilleder af halogenerede aromatiske forstadier deponeret på en sølvoverflade. Individuelle atomer kan ses i disse billeder. Kredit:WILEY-VCH Verlag GmbH &Co. KGaA, Weinheim
Visualisering af hvert trin i cycloaddition-reaktioner på overfladenScanning af tunnelmikroskopibilleder af halogenerede aromatiske forstadier deponeret på en sølvoverflade. Individuelle atomer kan ses i disse billeder. Kredit:WILEY-VCH Verlag GmbH &Co. KGaA, Weinheim -
 Ikke for våd, ikke for tør – plasmabehandlet brændselscelle får det helt rigtigtStudieforfatter Benjamin Zahiri, en materialeforsker Kredit:Benjamin Zahiri Brændselsceller lover som en ren, vedvarende energikilde. Men at holde dem tørre har længe været en udfordring, da de pr
Ikke for våd, ikke for tør – plasmabehandlet brændselscelle får det helt rigtigtStudieforfatter Benjamin Zahiri, en materialeforsker Kredit:Benjamin Zahiri Brændselsceller lover som en ren, vedvarende energikilde. Men at holde dem tørre har længe været en udfordring, da de pr -
 Video:Sådan tilbereder du et æg uden varme - og anden underlig ægvidenskabKredit:The American Chemical Society Man kan lære meget af æg. Den alsidige, lækker, ydmygt hønseæg. Du kan låse op for universets hemmeligheder med æg, eller i det mindste et par af dem gennem d
Video:Sådan tilbereder du et æg uden varme - og anden underlig ægvidenskabKredit:The American Chemical Society Man kan lære meget af æg. Den alsidige, lækker, ydmygt hønseæg. Du kan låse op for universets hemmeligheder med æg, eller i det mindste et par af dem gennem d
- Hvad er gruppens placering af cadmium?
- Brugen af fødevarebanker steg kraftigt under pandemien - men de kan sjældent give al den hjælp,…
- Hvad reagerer med syrer for at afgive kuldioxid?
- Forskel mellem bakterie og plantecelle Wall
- Justice Dept. sætter Big Tech under antitrustmikroskopet
- Hvad er 6 og en halv sten i lbs?


