Hvor mange mol N2 er der ved en temperatur 20 grader Celsius 1 ATM -tryk, hvis gassen optager 44 liter?
1. Konverter temperatur til Kelvin
* T (k) =t (° C) + 273.15
* T (k) =20 ° C + 273,15 =293,15 K
2. Brug den ideelle gaslov
* PV =NRT
* P =tryk (atm) =1 atm
* V =volumen (L) =44 L
* n =antal mol (mol)
* R =ideel gas konstant =0,0821 l · atm/mol · k
* T =temperatur (k) =293,15 k
3. Løs for N (mol)
* n =(PV) / (RT)
* n =(1 atm * 44 L) / (0,0821 L · ATM / Mol · K * 293,15 K)
* n ≈ 1,84 mol
Derfor er der ca. 1,84 mol N2 -gas under disse forhold.
Sidste artikelHvor mange mol fluor i 3 borontrifluorid?
Næste artikelHvor mange mol er der i 1,8 gram fluor?
 Varme artikler
Varme artikler
-
 Nye 2-D spektroskopi metoderI EEI2D spektroskopi (venstre), to oprindeligt adskilte excitationer (gule pile) mødes. Med 2D massespektrometri (højre), ionfotoprodukter (sorte pile) detekteres. Kredit:Tobias Brixner, JMU Sæt e
Nye 2-D spektroskopi metoderI EEI2D spektroskopi (venstre), to oprindeligt adskilte excitationer (gule pile) mødes. Med 2D massespektrometri (højre), ionfotoprodukter (sorte pile) detekteres. Kredit:Tobias Brixner, JMU Sæt e -
 Udrydde et mærkeligt fænomen, der både hjælper og skader lithium-ion-batteriets ydeevneAli Sundermier En mystisk proces kaldet oxygenoxidation fjerner elektroner fra oxygenatomer i lithiumrige batterikatoder og forringer deres ydeevne, vist til venstre. Bedre forståelse af denne egenska
Udrydde et mærkeligt fænomen, der både hjælper og skader lithium-ion-batteriets ydeevneAli Sundermier En mystisk proces kaldet oxygenoxidation fjerner elektroner fra oxygenatomer i lithiumrige batterikatoder og forringer deres ydeevne, vist til venstre. Bedre forståelse af denne egenska -
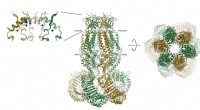 Cellulær ventilstruktur åbner op for potentielle nye terapierProteinet, som består af seks underenheder, er vist som et bånd. Membranens position er angivet med linjer. Selektivitetsfilteret er afbildet som indsat (højre). Positionerne for positivt ladede amino
Cellulær ventilstruktur åbner op for potentielle nye terapierProteinet, som består af seks underenheder, er vist som et bånd. Membranens position er angivet med linjer. Selektivitetsfilteret er afbildet som indsat (højre). Positionerne for positivt ladede amino -
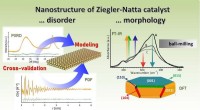 Belysning af nanostrukturer i praktiske heterogene katalysatorerNanostrukturen af den heterogene Ziegler-Natta-katalysator blev klarlagt på basis af banebrydende analytiske teknikker. Til venstre:Typiske synkrotrondata og den bestemte nanopartikelmodel af kataly
Belysning af nanostrukturer i praktiske heterogene katalysatorerNanostrukturen af den heterogene Ziegler-Natta-katalysator blev klarlagt på basis af banebrydende analytiske teknikker. Til venstre:Typiske synkrotrondata og den bestemte nanopartikelmodel af kataly
- Det gamle Texas Serengeti havde elefantlignende dyr, næsehorn, alligatorer og meget mere
- Coronavirus:Universiteter skifter klasser online, men det er ikke så nemt som det lyder
- Vores første kig på et nyt lysabsorberende protein i cyanobakterier
- Hvilken enhed bruges til at meause vægtet gennemsnitlig atommasse?
- Astronomer opdager monster-quasar fra det tidlige univers
- Er det synligt lys som ultraviolet lys?


