Hvad er formålet med at tilføje vand til basen?
1. Fortynding:
* Faldende koncentration: Vand fortynder basen og reducerer dens koncentration. Dette er nyttigt til:
* Oprettelse af løsninger: At forberede opløsninger af en bestemt molaritet (koncentration).
* sikkerhed: At reducere styrken af en koncentreret base, hvilket gør det mere sikkert at håndtere.
* reaktioner: At kontrollere reaktionshastigheden ved at bremse den i nogle tilfælde.
2. Opløsning af faste stoffer:
* opløselighed: Mange baser er faste stoffer, der skal opløses i vand for at gøre dem anvendelige. Vand fungerer som et opløsningsmiddel.
* Hydroxidioner: Når nogle baser opløses i vand, frigiver de hydroxidioner (OH-), som bidrager til opløsningens grundlæggende.
3. Kemiske reaktioner:
* neutralisering: I syre-base-reaktioner kan tilsætning af vand til en base hjælpe med neutraliseringsprocessen. Vand fungerer som et medium til, at reaktionen finder sted.
* Hydrolyse: Nogle baser gennemgår hydrolysereaktioner i vand, hvor basen reagerer med vandmolekyler for at danne forskellige produkter.
4. Andre formål:
* Temperaturkontrol: Tilføjelse af vand til en base kan hjælpe med at afkøle det, da opløsningsprocessen kan være eksoterm (varmefrigørelse).
* rengøring: Fortyndede baser bruges i mange rengøringsprodukter til at nedbryde fedt og snavs.
Vigtig note: Træk altid forsigtighed ved håndtering af baser. De kan være ætsende og forårsage forbrændinger. Det er vigtigt at bære passende sikkerhedsudstyr og følge ordentlige håndteringsprocedurer.
Eksempel:
Natriumhydroxid (NaOH) er en stærk base. Når det tilsættes til vand, opløses det og frigiver hydroxidioner, hvilket øger opløsningens pH. Denne proces kan bruges til at fremstille en løsning af en specifik NaOH -koncentration til forskellige applikationer.
 Varme artikler
Varme artikler
-
 Brændstof fra udtjente dækKredit:CC0 Public Domain Brugte dæk udgør en alvorlig miljørisiko på grund af de skader, der kan opstå, når de opbevares i miljøet. De dukker op i stadig større antal fra det ene år til det andet
Brændstof fra udtjente dækKredit:CC0 Public Domain Brugte dæk udgør en alvorlig miljørisiko på grund af de skader, der kan opstå, når de opbevares i miljøet. De dukker op i stadig større antal fra det ene år til det andet -
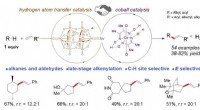 Ny metode til funktionalisering af carbon-hydrogen-bindinger i de sene stadierIllustration, der viser (øverst) den stedselektive C-H-alkenylering i det sene trin ved brug af synergistisk hydrogenatomoverførsel og koboltkatalyse i nærvær af lys (hv). (Bund) Udvalg af kemiske pro
Ny metode til funktionalisering af carbon-hydrogen-bindinger i de sene stadierIllustration, der viser (øverst) den stedselektive C-H-alkenylering i det sene trin ved brug af synergistisk hydrogenatomoverførsel og koboltkatalyse i nærvær af lys (hv). (Bund) Udvalg af kemiske pro -
 Indeholder en atomulykke med grundmineralerSandia National Laboratories forskergruppemedlemmer Jessica Kruichak og William Chavez testede granuleret calcit og sand mod blyoxid. Det granulære calcit og blyoxid havde en hævnings- og afkølingsrea
Indeholder en atomulykke med grundmineralerSandia National Laboratories forskergruppemedlemmer Jessica Kruichak og William Chavez testede granuleret calcit og sand mod blyoxid. Det granulære calcit og blyoxid havde en hævnings- og afkølingsrea -
 En ny måde at pakke flydende dråber på kan forbedre medicinafgivelsenKredit:CC0 Public Domain Forskere har udviklet en hurtigere, billigere måde at belægge flydende medicin på, en opfindelse, der kunne forbedre, hvordan lægemidler afgives i kroppen. Den nye indkap
En ny måde at pakke flydende dråber på kan forbedre medicinafgivelsenKredit:CC0 Public Domain Forskere har udviklet en hurtigere, billigere måde at belægge flydende medicin på, en opfindelse, der kunne forbedre, hvordan lægemidler afgives i kroppen. Den nye indkap
- En tredje La Niña i træk er sandsynligvis - her er, hvordan du og din familie kan forberede dig
- Længe mistænkt teori om månen holder vand
- Undersøgelse forudsiger betydelig strand erosion i det sydlige Californien
- Forskere opdager, hvordan routere kan rekrutteres til botnet-hæren
- Hvad står biologi for?
- Forudsigelse af orkanskader gennem semantiske webressourcer


