Hvorfor kaldes organiske opløsningsmidler ikke -polært opløsningsmiddel?
Hvorfor mange organiske opløsningsmidler er ikke -polære:
* struktur: Organiske molekyler er generelt sammensat af kulstof og brint, som har lignende elektronegativitet. Dette betyder, at elektronerne deles relativt ligeligt mellem dem, hvilket fører til en afbalanceret fordeling af ladning og et ikke -polært molekyle.
* Intermolekylære kræfter: Ikke -polære molekyler udviser primært svage London -spredningskræfter (LDF'er), der opstår som følge af midlertidige udsving i elektronfordeling. Disse kræfter er svagere end dipol-dipol-interaktioner eller hydrogenbinding, der findes i polære molekyler.
Eksempler på ikke -polære organiske opløsningsmidler:
* hexan
* diethylether
* toluen
* benzen
* chloroform
polære organiske opløsningsmidler:
Der er også flere organiske opløsningsmidler, der udviser polaritet:
* methanol
* ethanol
* acetone
* dimethylsulfoxid (DMSO)
* tetrahydrofuran (THF)
Disse molekyler indeholder funktionelle grupper som hydroxyl (-OH), carbonyl (C =O) eller ether (C-O-C), der indfører en signifikant forskel i elektronegativitet, hvilket fører til et dipolmoment og fremstiller molekylet polært.
Key Takeaway:
Mens mange organiske opløsningsmidler er ikke -polære på grund af deres molekylstruktur og svage intermolekylære kræfter, er det vigtigt at huske, at nogle organiske opløsningsmidler er polære. Se altid et opløsningsmiddels specifikke egenskaber, før du bruger det i enhver applikation.
 Varme artikler
Varme artikler
-
 Forståelse af de strukturelle og kemiske heterogeniteter af overfladearter ved enkeltbindingsgræns…Transformationer af pentacen på Ag(110) overfladen. (A) Atomisk opløst Ag(110) overflade med adsorberet pentacen og CO-molekyler. STM billeddannelsesbetingelser:60 mV og 1000 pA med en CO-dekoreret sp
Forståelse af de strukturelle og kemiske heterogeniteter af overfladearter ved enkeltbindingsgræns…Transformationer af pentacen på Ag(110) overfladen. (A) Atomisk opløst Ag(110) overflade med adsorberet pentacen og CO-molekyler. STM billeddannelsesbetingelser:60 mV og 1000 pA med en CO-dekoreret sp -
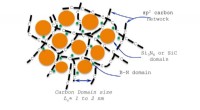 Ingeniøren patenterer vandlignende polymer for at skabe keramik ved høj temperaturDenne grafik viser strukturen af en keramik fremstillet af en Kansas State University-patenteret vandlignende polymer. Keramikken har en tilfældig struktur, der giver stabilitet ved høje temperature
Ingeniøren patenterer vandlignende polymer for at skabe keramik ved høj temperaturDenne grafik viser strukturen af en keramik fremstillet af en Kansas State University-patenteret vandlignende polymer. Keramikken har en tilfældig struktur, der giver stabilitet ved høje temperature -
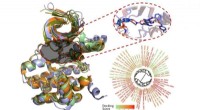 Computermodellering af WNK-kinasehæmmere kunne tilbyde nye værktøjer til at forstå hypertensionKredit:North Carolina State University Forskere fra North Carolina State University har modelleret og analyseret bindingsmåderne for 210 molekyler, der tidligere er rapporteret at hæmme funktionen
Computermodellering af WNK-kinasehæmmere kunne tilbyde nye værktøjer til at forstå hypertensionKredit:North Carolina State University Forskere fra North Carolina State University har modelleret og analyseret bindingsmåderne for 210 molekyler, der tidligere er rapporteret at hæmme funktionen -
 Ny letvægtsmetal lige så formbar som aluminiumplade med 1,5 gange højere styrkeSammenligning af nyudviklede og konventionelle magnesiumlegeringsplader efter at de har været udsat for Erichsen-tests. Kredit:National Institute for Materials Science Et forskerhold ved NIMS og N
Ny letvægtsmetal lige så formbar som aluminiumplade med 1,5 gange højere styrkeSammenligning af nyudviklede og konventionelle magnesiumlegeringsplader efter at de har været udsat for Erichsen-tests. Kredit:National Institute for Materials Science Et forskerhold ved NIMS og N
- Ny teori om polymerlængde giver forbedrede estimater af DNA- og RNA -størrelse
- Utopi eller mareridt? Svaret ligger i, hvordan vi omfavner selvkørsel, elektriske og delte køretø…
- Ny skorpe dannes hvornår eller hvor?
- Er der virkelig noget liv 'derude'?
- Hvordan ændrer vand Månens oprindelseshistorie?
- Hvordan mikroberne i spildevandet kan gøre vores byer mere bæredygtige


