Hvad er forholdet mellem struktur af et atom- og atomspektre?
1. Atomstruktur:
* elektroner i orbitaler: Atomer består af en positivt ladet kerne omgivet af negativt ladede elektroner, der optager specifikke energiniveauer, kendt som orbitaler. Hver orbital svarer til en bestemt energitilstand.
* kvantemekanisk model: Elektrons opførsel styres af principperne for kvantemekanik. Elektroner findes i kvantiserede energilater, hvilket betyder, at de kun kan besætte diskrete energiniveauer.
* Energiniveauovergange: Når en elektron absorberer energi (f.eks. Fra varme eller lys), kan det hoppe til et højere energiniveau. Når det vender tilbage til et lavere energiniveau, frigiver det den overskydende energi som en foton af lys.
2. Atomspektre:
* Emissionsspektre: Når atomer er begejstrede, udsender de lys ved specifikke bølgelængder. Dette skaber et karakteristisk mønster af lyse linjer kendt som et emissionsspektrum.
* Absorptionsspektre: Når lys passerer gennem en prøve af atomer, absorberes visse bølgelængder af atomerne, hvilket forårsager et mønster af mørke linjer i spektret.
* spektrale linjer og energiniveau: Bølgelængderne af det udsendte eller absorberede lys svarer til energiforskellene mellem elektronenerginiveauet.
Forbindelse:
Forholdet ligger i det faktum, at atomspektre er en direkte konsekvens af de kvantiserede energiniveauer af elektroner inden for et atom .
* Hver spektrallinie svarer til en specifik energiovergang mellem to elektronenerginiveauer.
* Mønsteret med spektrale linjer er unikt for hvert element, så vi kan identificere elementer baseret på deres spektre.
Eksempel:
Den lyse røde linje i brintspektret svarer til overgangen af et elektron fra det tredje energiniveau (n =3) til det andet energiniveau (n =2). Denne overgang udsender en foton med en bestemt energi, svarende til bølgelængden af rødt lys.
Kortfattet:
Atomspektre stammer fra de kvantiserede energiniveauer af elektroner i atomer. Mønsteret af spektrale linjer bestemmes af de specifikke energiovergange, som elektroner kan gennemgå. Dette forhold giver os mulighed for at studere atomernes struktur ved at analysere deres spektre.
 Varme artikler
Varme artikler
-
 Sporing af pileups på batteriopladningsruten for at øge ydeevnenEn illustration af de strukturelle ændringer, der forekommer ved en metaloxidelektrode under battericykling. Den inderste cirkel viser strukturelle ændringer under lithiumekstraktion og lithiumindsætt
Sporing af pileups på batteriopladningsruten for at øge ydeevnenEn illustration af de strukturelle ændringer, der forekommer ved en metaloxidelektrode under battericykling. Den inderste cirkel viser strukturelle ændringer under lithiumekstraktion og lithiumindsætt -
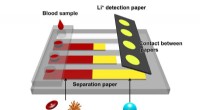 Ny enhed registrerer hurtigt lithiumioner i blod hos patienter med bipolar lidelseDen nyudviklede papirbaserede enhed kan let og billigt måle lithiumionkoncentrationen i blod. Kredit:Komatsu T. et al., ACS -sensorer, 23. april kl. 2020 En gruppe forskere på Hokkaido University
Ny enhed registrerer hurtigt lithiumioner i blod hos patienter med bipolar lidelseDen nyudviklede papirbaserede enhed kan let og billigt måle lithiumionkoncentrationen i blod. Kredit:Komatsu T. et al., ACS -sensorer, 23. april kl. 2020 En gruppe forskere på Hokkaido University -
 Forstå hvordan monomersekvens påvirker konduktans i molekylære ledningerForskere i Schroeder- og Moore-grupperne ved University of Illinois er interesserede i at bygge og studere kædemolekyler med høje præcisionsniveauer. På billedet fra venstre, Hao Yu, kandidatstuderend
Forstå hvordan monomersekvens påvirker konduktans i molekylære ledningerForskere i Schroeder- og Moore-grupperne ved University of Illinois er interesserede i at bygge og studere kædemolekyler med høje præcisionsniveauer. På billedet fra venstre, Hao Yu, kandidatstuderend -
 Forskere udvikler fleksibel krystal, baner vejen for mere effektiv bøjelig elektronikEt nærbillede af den nye piezoelektriske krystal udviklet af NTU -forskere, som kan bøje op til 40 gange mere end de konventionelle ferroelektriske krystaller, der typisk bruges i små aktuatorer og se
Forskere udvikler fleksibel krystal, baner vejen for mere effektiv bøjelig elektronikEt nærbillede af den nye piezoelektriske krystal udviklet af NTU -forskere, som kan bøje op til 40 gange mere end de konventionelle ferroelektriske krystaller, der typisk bruges i små aktuatorer og se
- Er det rigtigt, at der kun er 2 grundstoffer i flydende form, når er stuetemperatur?
- Undersøgelse af data fra 1988 shroud of Turin test tyder på fejl
- Hvad er lighederne mellem nuklear fission og fusion?
- Sådan konverteres kubiske målere til Ton
- Kan to stoffer i en opløsning let adskilles?
- Forskere undersøger molekylær gasemission fra galaksen NGC 3557


