Hvilken slags hybrid orbital bruges i CO2?
* struktur: CO2 har en lineær struktur med carbonatomet i midten og to iltatomer bundet til det ved 180-graders vinkler.
* Hybridisering: For at imødekomme denne lineære geometri og de to dobbeltbindinger med ilt, skal carbonatomet have to hybrid -orbitaler, der peger i modsatte retninger. Dette opnås gennem SP -hybridisering, hvor en s orbital og en P -orbital fra carbonatomet kombineres for at danne to SP -hybrid -orbitaler.
* binding: De to SP -hybrid -orbitaler på carbonatomet danner sigma -bindinger med iltatomerne. De resterende to P -orbitaler på carbonatomet danner PI -bindinger med iltatomerne, hvilket resulterer i dobbeltbindingerne.
Så carbonatomet i CO2 bruger to SP -hybrid -orbitaler til at danne sigma -bindingerne med iltatomerne, hvilket resulterer i en lineær struktur.
 Varme artikler
Varme artikler
-
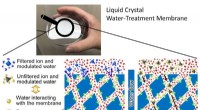 Meget selektive membraner:Forskere opdager, hvordan vand kan påvirke sin egen filtreringDen subnanoporøse væske-krystallinske vandbehandlingsmembran kan være meget selektiv med hensyn til, hvad den lader passere igennem. Kredit:Kato og Harada et al. Membraner med mikroskopiske porer
Meget selektive membraner:Forskere opdager, hvordan vand kan påvirke sin egen filtreringDen subnanoporøse væske-krystallinske vandbehandlingsmembran kan være meget selektiv med hensyn til, hvad den lader passere igennem. Kredit:Kato og Harada et al. Membraner med mikroskopiske porer -
 Billig, miljøvenlig katalysator åbner nye muligheder for organiske molekyler bygget af pyruvatPh.d.-studerende og førsteforfatter, Santanu Mondal, skitserer en reaktion af pyruvat ved at bruge en model af hans nydesignede organiske katalysatorsystem som reference. Kredit:OIST Kemikere ved O
Billig, miljøvenlig katalysator åbner nye muligheder for organiske molekyler bygget af pyruvatPh.d.-studerende og førsteforfatter, Santanu Mondal, skitserer en reaktion af pyruvat ved at bruge en model af hans nydesignede organiske katalysatorsystem som reference. Kredit:OIST Kemikere ved O -
 Forskere tilbyder ny metode til at sætte skub i forskningen i ren energiEn ny katalysatordesignmetode foreslået af UD-forskere vil hjælpe med at producere mere effektive og mere effektive brændselsceller. Dion Vlachos (ovenfor), Allan og Myra Fergusons formand for Chemica
Forskere tilbyder ny metode til at sætte skub i forskningen i ren energiEn ny katalysatordesignmetode foreslået af UD-forskere vil hjælpe med at producere mere effektive og mere effektive brændselsceller. Dion Vlachos (ovenfor), Allan og Myra Fergusons formand for Chemica -
 Klarhed nødvendig i klassificeringssystemer til forarbejdede fødevarerKredit:Pixabay/CC0 Public Domain Nuværende fødevareklassifikationssystemer for forarbejdede fødevarer mangler konsistens og konsensus, der ofte fører til forvirring og debat, selv blandt forskere,
Klarhed nødvendig i klassificeringssystemer til forarbejdede fødevarerKredit:Pixabay/CC0 Public Domain Nuværende fødevareklassifikationssystemer for forarbejdede fødevarer mangler konsistens og konsensus, der ofte fører til forvirring og debat, selv blandt forskere,


