Hvorfor ruster stoffer?
1. Ingredienserne:
* jern: Det metal, der ruster.
* ilt: Til stede i luften.
* Vand: Kan være i form af fugt i luften eller endda bare fugtighed.
2. Reaktionen:
* Når jern kommer i kontakt med ilt og vand, reagerer det på dannelse af jernoxid , hvad vi kender som rust.
* Jernatomerne mister elektroner og bliver jernioner , mens iltatomerne får elektroner, danner oxidioner .
* Denne kemiske reaktion er elektrokemisk , hvilket betyder, at det involverer overførsel af elektroner.
3. Processen:
* Korrosion: Dette er den gradvise ødelæggelse af metallet ved den kemiske reaktion.
* rødbrune flager: Det dannede jernoxid er et sprødt, flassende stof, som vi genkender som rust.
* Spredning: Når rust dannes, skaber det mere overfladeareal for reaktionen at fortsætte, hvilket fører til yderligere korrosion.
4. Hvorfor rust sker:
* fugt: Tilstedeværelsen af vand er afgørende for, at rust forekommer. Vand fungerer som en elektrolyt , der tillader overførsel af elektroner at finde sted.
* ilt: Oxygen er nødvendig for den kemiske reaktion for at danne jernoxid.
* surhed: Syrer kan fremskynde rustningsprocessen ved at øge hastigheden af den kemiske reaktion.
5. Forebyggelse af rust:
* belægning: Påføring af en beskyttende belægning som maling, olie eller fedt forhindrer ilt og vand i at kontakte metallet.
* galvanisering: Anvendelse af en zinkbelægning på jern (galvanisering) giver et offerlag, der først korroderer, der beskytter jernet.
* rustfrit stål: Tilsætning af krom til stål gør det mere modstandsdygtigt over for korrosion.
Kort sagt er Rust en kemisk reaktion mellem jern, ilt og vand, der resulterer i dannelsen af jernoxid, hvilket fører til gradvis forringelse af metallet.
 Varme artikler
Varme artikler
-
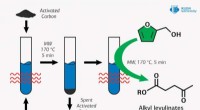 Chemist foreslår ny måde at forbedre brændstofkvaliteten ved hjælp af mikrobølgebestrålingKredit:RUDN Universitet En kemiker fra RUDN University har fundet en miljøvenlig måde at opnå estere af levulinsyre, der bruges som brændstoftilsætningsstof til kemisk syntese. Sammen med kolleger
Chemist foreslår ny måde at forbedre brændstofkvaliteten ved hjælp af mikrobølgebestrålingKredit:RUDN Universitet En kemiker fra RUDN University har fundet en miljøvenlig måde at opnå estere af levulinsyre, der bruges som brændstoftilsætningsstof til kemisk syntese. Sammen med kolleger -
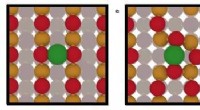 Forskere foreslår en dynamisk ladning og oxidationstilstand for enkeltatom-katalysatorerResultaterne, udgivet i Naturmaterialer , gøre det amerikanske energiministerium 150ºC udfordring for emissioner mere opnåelige. Forskere fra López-gruppen foreslår en dynamisk ladning og oxidations
Forskere foreslår en dynamisk ladning og oxidationstilstand for enkeltatom-katalysatorerResultaterne, udgivet i Naturmaterialer , gøre det amerikanske energiministerium 150ºC udfordring for emissioner mere opnåelige. Forskere fra López-gruppen foreslår en dynamisk ladning og oxidations -
 Undersøgelsen stiller spørgsmålstegn ved blyforgiftningens rolle i Franklin Expeditions dødsfaldI sommeren 1845 under kommando af Sir John Franklin, 128 officerer og besætning ombord på skibene HMS Erebus, over, og HMS Terror kom ind i farvandene i det arktiske Nordamerika med det mål at fuldfør
Undersøgelsen stiller spørgsmålstegn ved blyforgiftningens rolle i Franklin Expeditions dødsfaldI sommeren 1845 under kommando af Sir John Franklin, 128 officerer og besætning ombord på skibene HMS Erebus, over, og HMS Terror kom ind i farvandene i det arktiske Nordamerika med det mål at fuldfør -
 Teknik til at genvinde fosfor fra urinFosfor er en vigtig ingrediens i mange gødninger, der bruges til at hjælpe med at dyrke vores plantebaserede fødevarer. Kredit:Shutterstock/otick Fosfor, nummer 15 i det periodiske system, kan vær
Teknik til at genvinde fosfor fra urinFosfor er en vigtig ingrediens i mange gødninger, der bruges til at hjælpe med at dyrke vores plantebaserede fødevarer. Kredit:Shutterstock/otick Fosfor, nummer 15 i det periodiske system, kan vær
- Mælkevejs galakse omvendt manipuleret
- Ræveegern viser langsigtet investeringsbevidsthed, når de hamstrer nødder
- Automatiseret klargøring af MS-følsomme fluorescensmærkede N-Glycaner med en pipeteringsrobot
- Forskere finder retning, der bestemmes af hastigheden af møntvending i kvanteverdenen
- Sådan fungerer sorte huller
- Hvis sukker opløses i vand, hvilken komponent vil være det opløste og opløsningsmiddel?


