Hvor mange gram CO2 bruges, når 8,0 g O2 produceres?
1. Afbalanceret kemisk ligning:
Den reaktion, du beskriver, er forbrænding af en kulstofholdig forbindelse (som et carbonhydrid) til at producere kuldioxid (CO2) og vand (H2O). Da vi kun interesserer os for ilt og kuldioxid, kan vi forenkle ligningen:
C + O2 → CO2
2. Molforhold:
Den afbalancerede ligning viser, at 1 mol O2 producerer 1 mol CO2.
3. Molmasse:
* Den molære masse af O2 er 32 g/mol (16 g/mol for hvert iltatom).
* Den molære masse af CO2 er 44 g/mol (12 g/mol for carbon og 32 g/mol for ilt).
4. Beregning:
* Trin 1: Beregn molen af O2:
mol af O2 =masse af O2 / molmasse af O2 =8,0 g / 32 g / mol =0,25 mol
* Trin 2: Da molforholdet på O2 og CO2 er 1:1, har du 0,25 mol produceret CO2.
* Trin 3: Beregn massen af CO2:
Masse CO2 =mol CO2 * Molmasse CO2 =0,25 mol * 44 g/mol =11 g
Svar: 11 gram CO2 bruges, når der produceres 8,0 gram O2.
 Varme artikler
Varme artikler
-
 Femdobbelt boost i formaldehydudbytteReaktorer, der anvendes til parallel screening af virkningerne af forskellige tryk på formaldehydsyntese. Kredit:O. Trapp Der er et presserende behov for miljøvenlige metoder til industriel produk
Femdobbelt boost i formaldehydudbytteReaktorer, der anvendes til parallel screening af virkningerne af forskellige tryk på formaldehydsyntese. Kredit:O. Trapp Der er et presserende behov for miljøvenlige metoder til industriel produk -
 Udvikling af fibrilleret cellulose som et bæredygtigt teknologisk materialeKredit:Dr.Hua Xie for University of Maryland, College Park Nanocellulose beklæder planters cellevægge, træer, alger og bakterier bestående af glukoseringe, der kæder sammen som en kæde og giver de
Udvikling af fibrilleret cellulose som et bæredygtigt teknologisk materialeKredit:Dr.Hua Xie for University of Maryland, College Park Nanocellulose beklæder planters cellevægge, træer, alger og bakterier bestående af glukoseringe, der kæder sammen som en kæde og giver de -
 Kraftværker drevet af lysKredit:CC0 Public Domain Grønne planter, alger og nogle bakterier bruger sollys til at omdanne energi. Pigmenterne i klorofyl absorberer elektromagnetisk stråling, som fremkalder kemiske reaktione
Kraftværker drevet af lysKredit:CC0 Public Domain Grønne planter, alger og nogle bakterier bruger sollys til at omdanne energi. Pigmenterne i klorofyl absorberer elektromagnetisk stråling, som fremkalder kemiske reaktione -
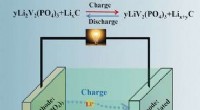 Højhastigheds- og langtidsholdbart lithium-ion-batteri med forbedret ydeevne ved lav temperatur gen…Kredit:Wiley Når det er koldt om vinteren, biler har en tendens til at have startproblemer. Dette er ikke meget bedre med elbiler, som uundgåeligt mister kapaciteten af deres genopladelige lithi
Højhastigheds- og langtidsholdbart lithium-ion-batteri med forbedret ydeevne ved lav temperatur gen…Kredit:Wiley Når det er koldt om vinteren, biler har en tendens til at have startproblemer. Dette er ikke meget bedre med elbiler, som uundgåeligt mister kapaciteten af deres genopladelige lithi
- Ny 3D-visning af metanspor kilder
- Hvordan vores planter er blevet til tyve for at overleve
- Forskere efterlyser forbedrede teknologier for at redde udsatte californiske laks
- Lipid nanopartikler, der leverer mRNA til T-celler, lover godt mod autoimmune sygdomme
- En ramme til at simulere den samme fysik ved hjælp af to forskellige Hamiltonianere
- Hvad former tarmmikrobiomer af Alaskas brune bjørne? Beliggenhed, beliggenhed, beliggenhed


