Hvordan beregnes Moleculer -formlen for en forbindelse, hvis den er kendt?
forståelse af koncepterne
* Empirisk formel: Det enkleste forhold mellem hele nummeret for atomer i en forbindelse.
* molekylær formel: Det faktiske antal atomer i hvert element i et molekyle.
trin til beregning af molekylformlen
1. Bestem den empiriske formelmasse: Tilsæt atommasser af alle atomer i den empiriske formel.
2. Bestem molekylmassen: Dette leveres normalt i problemet. Du kan også finde det eksperimentelt ved hjælp af teknikker som massespektrometri.
3. Beregn forholdet: Del molekylmassen med den empiriske formelmasse.
4. Multiplicer den empiriske formel: Multiplicer underskrifterne i den empiriske formel med det forhold, du beregnet i trin 3. Dette giver dig den molekylære formel.
Eksempel:
Lad os sige, at du har en forbindelse med:
* Empirisk formel: Ch₂o
* molekylær masse: 180 g/mol
1. Empirisk formelmasse: (12,01 g/mol C) + (2 * 1,01 g/mol H) + (16,00 g/mol O) =30,03 g/mol
2. forhold: 180 g/mol/30,03 g/mol ≈ 6
3. molekylær formel: Multiplicer underskrifterne i ch₂o med 6:c₆h₁₂o₆
Derfor er den molekylære formel for forbindelsen c₆h₁₂o₆ (glukose).
Nøglepunkter
* Den molekylære formel vil altid være et multiplum med hele nummer af den empiriske formel.
* Hvis molekylmassen og den empiriske formelmasse er den samme, er den empiriske formel også den molekylære formel.
* Du kan bruge den molekylære formel til at beregne den procentvise sammensætning efter masse af hvert element i forbindelsen.
 Varme artikler
Varme artikler
-
 Biodiesel lavet af kasserede papkasserKonceptuelt diagram til fremstilling af biobrændstoffer ved hjælp af mikroorganismer som råmateriale til træbaseret biomasse. Kredit:Korea Institute of Science and Technology (KIST) Biludstødning
Biodiesel lavet af kasserede papkasserKonceptuelt diagram til fremstilling af biobrændstoffer ved hjælp af mikroorganismer som råmateriale til træbaseret biomasse. Kredit:Korea Institute of Science and Technology (KIST) Biludstødning -
 AI -algoritme identificerer ny forbindelse, der potentielt kan bruges til fotoniske enheder, biologi…Kredit:CC0 Public Domain Når ordene kunstig intelligens (AI) kommer til at tænke på, dine første tanker kan være super-smarte computere, eller robotter, der udfører opgaver uden at have brug for h
AI -algoritme identificerer ny forbindelse, der potentielt kan bruges til fotoniske enheder, biologi…Kredit:CC0 Public Domain Når ordene kunstig intelligens (AI) kommer til at tænke på, dine første tanker kan være super-smarte computere, eller robotter, der udfører opgaver uden at have brug for h -
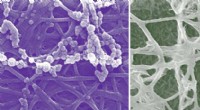 Ny cellulær indsigt i knogleudviklingCalciumphosphatmineralisering forekommer i både ekstra- og intrafibrillære rum af kollagen (venstre og højre billeder, henholdsvis). Ingeniører ved Washington University i St. Louis forsøgte eksperime
Ny cellulær indsigt i knogleudviklingCalciumphosphatmineralisering forekommer i både ekstra- og intrafibrillære rum af kollagen (venstre og højre billeder, henholdsvis). Ingeniører ved Washington University i St. Louis forsøgte eksperime -
 Se mor, ingen hænder:Forskere bruger vakuum til håndfri mønstre af flydende metalNorth Carolina State University ingeniører har brugt vakuum til at skabe en mere effektiv, håndfri metode til at fylde komplekse mikrokanaler med flydende metal. Deres arbejde adresserer to af de mest
Se mor, ingen hænder:Forskere bruger vakuum til håndfri mønstre af flydende metalNorth Carolina State University ingeniører har brugt vakuum til at skabe en mere effektiv, håndfri metode til at fylde komplekse mikrokanaler med flydende metal. Deres arbejde adresserer to af de mest
- Hvordan tiden påvirker stamcellernes skæbne
- Hvordan kunne du reparere en elektrisk ventilator, der ikke fungerer korrekt, anvender en videnskabe…
- Ekstremt vejr har begrænset effekt på holdninger til klimapolitikker
- Forskere skaber en AI for at hjælpe os med at forstå privatlivspolitikker
- Forskere 3D-print roterende mikrofilter til laboratorie-på-en-chip-applikationer
- Hvad er den balancerede ligning for forbrænding af butan-1-ol?


