Hvorfor er flydende form af et materiale generelt køligere end gassen det samme materiale?
Generelt:
* væsker har stærkere intermolekylære kræfter: Molekyler i væsker er tættere sammen end i gasser og oplever stærkere attraktioner. Disse attraktioner kræver energi til at overvinde, hvilket betyder, at væsker generelt har lavere kinetisk energi (og dermed lavere temperatur) end gasser.
* væsker er mere tætte: Tætheden af en væske er meget højere end tætheden af en gas. Dette betyder, at væsker har flere molekyler pakket i et givet volumen, hvilket kan føre til flere kollisioner og en lavere gennemsnitlig kinetisk energi.
Undtagelser:
* kogepunkt: Når en væske når sit kogepunkt, begynder den at ændre sig til en gas. På dette tidspunkt kan gasfasen * være på den samme temperatur som den flydende fase.
* overophedede væsker: Under visse betingelser kan væsker opvarmes over deres kogepunkt uden kogning. Dette kaldes en "overophedet væske" og kan være * varmere * end gasfasen af det samme materiale.
* specifikke materialer: Nogle materialer, som vand, har en unik egenskab, hvor deres solide form (is) er * mindre tæt * end den flydende form. Dette er grunden til, at is flyder! I disse tilfælde kan den faste form være * koldere * end den flydende form.
Kortfattet:
Selv om det er sandt, at væsker generelt har lavere temperaturer end gasser af det samme materiale, er dette ikke altid tilfældet. Materialets specifikke forhold og egenskaber spiller en afgørende rolle.
Sidste artikelHvad hedder det pigment, der indeholder jern?
Næste artikelHvad identificerer kemiske egenskaber?
 Varme artikler
Varme artikler
-
 Et levende lys-lignende skær fra en fleksibel organisk LEDEn bøjelig organisk LED med en naturlig glimmerbagside frigiver en stærk, levende lys-lignende glød. Kredit:Andy Chen og Ambrose Chen Stearinlys giver en behagelig glød og sætter stemningen til en
Et levende lys-lignende skær fra en fleksibel organisk LEDEn bøjelig organisk LED med en naturlig glimmerbagside frigiver en stærk, levende lys-lignende glød. Kredit:Andy Chen og Ambrose Chen Stearinlys giver en behagelig glød og sætter stemningen til en -
 Hvordan to vandmolekyler danser sammenKredit:CC0 Public Domain Et internationalt forskerhold har fået ny indsigt i, hvordan vandmolekyler interagerer. En laser med særlig høj lysstyrke, som findes på FELIX-laboratoriet på Radboud Univ
Hvordan to vandmolekyler danser sammenKredit:CC0 Public Domain Et internationalt forskerhold har fået ny indsigt i, hvordan vandmolekyler interagerer. En laser med særlig høj lysstyrke, som findes på FELIX-laboratoriet på Radboud Univ -
 Ultralyse røntgenudbrud afslører, hvordan planter reagerer på lys inden for en brøkdel af et sek…Kredit:Claesson et al., 2020 (CC BY 4.0) Forskere har afsløret indviklede strukturelle ændringer i planter, svampe og bakterier som reaktion på lys, ifølge en ny undersøgelse offentliggjort i dag
Ultralyse røntgenudbrud afslører, hvordan planter reagerer på lys inden for en brøkdel af et sek…Kredit:Claesson et al., 2020 (CC BY 4.0) Forskere har afsløret indviklede strukturelle ændringer i planter, svampe og bakterier som reaktion på lys, ifølge en ny undersøgelse offentliggjort i dag -
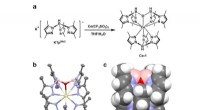 Dybblå organiske lysemitterende dioder baseret på et dublet-emission cerium(III) kompleksen. Syntetisk rute for komplekset. b. Enkeltkrystalstruktur af komplekset vist som ellipsoider ved 50 % sandsynlighedsniveau, hvor gul repræsenterer Ce, pink repræsenterer B, blå repræsenterer N, rød
Dybblå organiske lysemitterende dioder baseret på et dublet-emission cerium(III) kompleksen. Syntetisk rute for komplekset. b. Enkeltkrystalstruktur af komplekset vist som ellipsoider ved 50 % sandsynlighedsniveau, hvor gul repræsenterer Ce, pink repræsenterer B, blå repræsenterer N, rød
- Juno kortlægger vandis på tværs af det nordlige Ganymedes
- Opvarmning af elbilmarkedet
- Fysiker finder en løs tråd af strengteori-puslespil
- Skift i rocklagets placeringer kan ikke redegøre for huller?
- Princeton-geologer løser fossilt mysterium ved at oprette en 3D-virtuel tur gennem sten
- Pitch of a Sound Wave er dens?


