Hvad er en metode, der bruges til at identificere antallet og placeringen af elektroner til bestemte atomer?
1. Atomnummer:
* Det atomnummer på et element fortæller dig antallet af protoner i dens kerne. Da atomer er elektrisk neutrale, er antallet af protoner også lig med antallet af elektroner.
2. Elektronskaller og underskaller:
* Elektroner er organiseret i energiniveau kaldet skaller . Hver skal er yderligere opdelt i underskaller med forskellige former og energiniveau (S, P, D og F).
* Antallet af elektroner, som hver underskal kan have, bestemmes af dets specifikke form og energiniveau:
* s subshell: holder op til 2 elektroner
* p underskal: holder op til 6 elektroner
* D Subshell: holder op til 10 elektroner
* f Subshell: holder op til 14 elektroner
3. Fyldning af skaller og underskaller:
* Elektroner udfylder skaller og underskaller efter specifikke regler:
* aufbau -princip: Elektroner udfylder først de laveste energiniveau.
* Hunds regel: Inden for et underskal vil elektroner besætte orbitaler individuelt, før de parrer sig sammen.
* Pauli Ekskluderingsprincip: Ingen to elektroner i et atom kan have det samme sæt med fire kvantetal (inklusive spin).
4. Elektronkonfigurationsnotation:
* Elektronkonfigurationen er skrevet ved hjælp af en kortvarig notation. For eksempel er elektronkonfigurationen af nitrogen (atomnummer 7):
* 1S²2S²2P³
* Dette betyder, at der er 2 elektroner i 1S -underskalet, 2 elektroner i underskalet på 2S og 3 elektroner i 2P -underskalet.
5. Orbitaldiagrammer:
* Orbitaldiagrammer er en mere visuel repræsentation af elektronkonfiguration. De bruger kasser til at repræsentere orbitaler og pile til at repræsentere elektroner.
Eksempel:
Lad os se på ilt (atomnummer 8):
* atomnummer: 8, hvilket betyder, at det har 8 elektroner.
* Elektronkonfiguration: 1S²2S²2P⁴
* Subshellet 2p har 4 elektroner, så det vil have en orbital med 2 elektroner og to orbitaler med 1 elektron hver.
* orbital diagram:
* 1S:↑ ↓
* 2S:↑ ↓
* 2p:↑ ↓ ↑ ↑
Ved at bruge elektronkonfiguration og orbitaldiagrammer kan du bestemme antallet og placeringen af elektroner for ethvert givet atom. Denne information er afgørende for at forstå et elements kemiske egenskaber, og hvordan det vil interagere med andre atomer.
 Varme artikler
Varme artikler
-
 Ny undersøgelse giver beviser for årtier gammel teori til at forklare vandets ulige adfærdEn ny undersøgelse fra Princeton University og Sapienza University of Rome giver stærke beviser for en kontroversiel teori om, at vand ved meget kolde temperaturer kan eksistere i to forskellige flyde
Ny undersøgelse giver beviser for årtier gammel teori til at forklare vandets ulige adfærdEn ny undersøgelse fra Princeton University og Sapienza University of Rome giver stærke beviser for en kontroversiel teori om, at vand ved meget kolde temperaturer kan eksistere i to forskellige flyde -
 En nemmere måde at spise grønt på:Vitamin B12 kan produceres under dejgæringKredit:CC0 Public Domain Vitamin B12 er et essentielt mikronæringsstof, der er nødvendigt for funktioner som vedligeholdelse af nervesystemet og dannelse af blodceller. Imidlertid, B12 findes hove
En nemmere måde at spise grønt på:Vitamin B12 kan produceres under dejgæringKredit:CC0 Public Domain Vitamin B12 er et essentielt mikronæringsstof, der er nødvendigt for funktioner som vedligeholdelse af nervesystemet og dannelse af blodceller. Imidlertid, B12 findes hove -
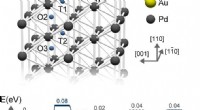 Hvorfor guld-palladium-legeringer er bedre end palladium til brintlagringAu-atomerne destabiliserer kemisorberet brint, dermed øge deres energi og reducere barrieren. Kredit:2018 Shohei Ogura, Institut for Industrividenskab, Universitetet i Tokyo Materialer, der absorb
Hvorfor guld-palladium-legeringer er bedre end palladium til brintlagringAu-atomerne destabiliserer kemisorberet brint, dermed øge deres energi og reducere barrieren. Kredit:2018 Shohei Ogura, Institut for Industrividenskab, Universitetet i Tokyo Materialer, der absorb -
 Fra insekt til lægemiddel - skovflåtspyt kan være nøglen til behandling af hjertesygdommeKredit:Shutterstock Proteiner, der findes i flåtspyt, kan bruges til at behandle en potentielt dødelig form for hjertesygdom, ifølge ny forskning fra Oxford University. Myokarditis kan forårsage
Fra insekt til lægemiddel - skovflåtspyt kan være nøglen til behandling af hjertesygdommeKredit:Shutterstock Proteiner, der findes i flåtspyt, kan bruges til at behandle en potentielt dødelig form for hjertesygdom, ifølge ny forskning fra Oxford University. Myokarditis kan forårsage
- Er røde himmel om natten en hyrders glæde? En astronoms opfattelse
- Hvorfor nogle mennesker besvimer, når de ser blod
- Forskere foreslår at bruge maskinlæring til at forudsige materialers egenskaber
- Hvad er forskellen mellem en eksoterm og endotermisk reaktion?
- Ny protokol identificerer fascinerende kvantetilstande
- Facebook siger, at det kan lokalisere brugere, der fravælger sporing


