Hvad er de faktorer, der påvirker materialernes opløselighed?
Faktorer, der påvirker opløselighed:
Opløselighed er et stofs (opløste stofs evne til at opløses i et andet stof (opløsningsmiddel) til at danne en homogen blanding (opløsning). De faktorer, der påvirker denne proces, er:
1. Natur af opløst stof og opløsningsmiddel:
* "som opløser som": Dette grundlæggende princip siger, at stoffer med lignende polariteter har en tendens til at opløses i hinanden. Polære opløsningsmidler (som vand) opløser polære opløste stoffer (som salte), mens ikke -polære opløsningsmidler (som olie) opløser ikke -polære opløste stoffer (som fedt).
* Intermolekylære kræfter: Styrken af intermolekylære kræfter mellem opløst stof og opløsningsmiddelmolekyler påvirker opløselighed. Stærkere interaktioner fører til større opløselighed.
* Kemisk struktur: Formen og funktionelle grupper af opløsningsmiddel- og opløsningsmiddelmolekyler kan påvirke deres evne til at interagere og opløses.
2. Temperatur:
* faste stoffer og væsker: For de fleste faste stoffer og væsker øges opløseligheden generelt med stigende temperatur. Dette skyldes, at højere temperaturer giver mere energi for molekyler til at overvinde de intermolekylære kræfter, der holder dem sammen, så de kan opløses.
* Gasser: Opløseligheden af gasser i væsker falder med stigende temperatur. Dette skyldes den højere kinetiske energi af gasmolekyler ved højere temperaturer, hvilket får dem til at flygte lettere fra væsken.
3. Tryk:
* Gasser: Opløseligheden af gasser i væsker øges med stigende tryk. Dette forklares af Henrys lov, der siger, at mængden af gas, der er opløst i en væske, er direkte proportional med det delvise tryk på gassen over væsken.
* væsker og faste stoffer: Trykket har ringe indflydelse på opløseligheden af væsker og faste stoffer.
4. Partikelstørrelse:
* faste stoffer: Mindre partikler af en fast opløses hurtigere end større partikler. Dette skyldes, at et større overfladeareal udsættes for opløsningsmidlet for interaktion.
5. Agitation:
* faste stoffer og gasser: Omrøring eller rystelse af en opløsning hjælper med at opløse opløsninger hurtigere ved at bringe frisk opløsningsmiddel i kontakt med de opløste partikler.
6. Koncentration:
* mættede løsninger: En opløsning betragtes som mættet, når den ikke kan opløse mere opløst stof ved en given temperatur og tryk. Yderligere tilsætning af opløst stof vil ikke resultere i opløsning, men snarere nedbør af overskydende opløsning.
* Umættede løsninger: En opløsning er umættet, hvis den kan opløses mere opløst ved en given temperatur og tryk.
7. Tilstedeværelse af andre opløste stoffer:
* fælles ioneffekt: Tilstedeværelsen af en almindelig ion (en ion, der allerede er til stede i opløsningen), kan reducere opløseligheden af et salt. Dette skyldes, at den øgede koncentration af den almindelige ion forskyder ligevægten mod fast tilstand.
8. Ph:
* syrer og baser: Opløseligheden af syrer og baser kan påvirkes af pH i opløsningen. For eksempel øges opløseligheden af nogle metalhydroxider i sure opløsninger.
9. Kemiske reaktioner:
* Kompleks dannelse: Dannelsen af opløselige komplekse ioner kan øge opløseligheden af et stof.
* nedbørreaktioner: Kemiske reaktioner kan føre til dannelse af uopløselige bundfald, hvilket kan reducere opløseligheden af visse ioner.
At forstå disse faktorer hjælper os med at forudsige og kontrollere opløseligheden af stoffer i forskellige situationer.
 Varme artikler
Varme artikler
-
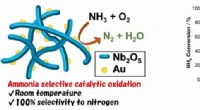 Gennembrud inden for luftrensning med en katalysator, der virker ved stuetemperatur(venstre) Forenklet skematisk oversigt over guldnanopartikler fastgjort til en ramme af nioboxid. (højre) Konverteringseffektivitet af filter med og uden guld, plus selektivitet til omdannelse til nit
Gennembrud inden for luftrensning med en katalysator, der virker ved stuetemperatur(venstre) Forenklet skematisk oversigt over guldnanopartikler fastgjort til en ramme af nioboxid. (højre) Konverteringseffektivitet af filter med og uden guld, plus selektivitet til omdannelse til nit -
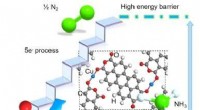 En ny strategi for elektrokemisk reduktion af nitrat til ammoniakForeslået struktur af Cu-inkorporeret PTCDA og skematisk diagram, der illustrerer dens fordel ved selektivt at reducere NO3− til NH3 via direkte 8-eletron overførsel. Rød, hvid, grå, strålende blå, og
En ny strategi for elektrokemisk reduktion af nitrat til ammoniakForeslået struktur af Cu-inkorporeret PTCDA og skematisk diagram, der illustrerer dens fordel ved selektivt at reducere NO3− til NH3 via direkte 8-eletron overførsel. Rød, hvid, grå, strålende blå, og -
 Kemikere bygger naturlig anti-cancer forbindelse med en effektiv ny procesKredit:CC0 Public Domain Scripps Research kemikere Hans Renata, Ph.D., og Alexander Adibekian, Ph.D., har opdaget en måde til effektivt at skabe en syntetisk version af en værdifuld naturlig forbi
Kemikere bygger naturlig anti-cancer forbindelse med en effektiv ny procesKredit:CC0 Public Domain Scripps Research kemikere Hans Renata, Ph.D., og Alexander Adibekian, Ph.D., har opdaget en måde til effektivt at skabe en syntetisk version af en værdifuld naturlig forbi -
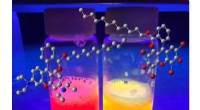 Lab producerer simple fluorescerende overfladeaktive stofferRice University kemikere har produceret en række fluorescerende overfladeaktive stoffer til billeddannelse, biomedicinske og fremstillingsapplikationer. Kredit:Ashleigh Smith McWilliams/Rice Universit
Lab producerer simple fluorescerende overfladeaktive stofferRice University kemikere har produceret en række fluorescerende overfladeaktive stoffer til billeddannelse, biomedicinske og fremstillingsapplikationer. Kredit:Ashleigh Smith McWilliams/Rice Universit
- Sådan sætter du ambitiøse mål for bæredygtigt landbrug
- Atomic dance afslører ny indsigt i udførelsen af 2-D materialer
- Hot-band absorption af Indocyanine Green til avanceret anti-Stokes fluorescens biobilleddannelse
- CES 2019:Buzz forbliver, da autonome biler tager bagsædet
- Hvordan kontrollerer du Amperage -træk på elektriske enheder, dvs. 12V bilindustrien?
- Hvad er navnet på vegeteret kystmudflat?


