Hvorfor er halogener oxideringsmidler?
Elektronegativitet:
* Halogener har en høj elektronegativitet, hvilket betyder, at de stærkt tiltrækker elektroner. Dette gør dem ivrige efter at få et elektron for at afslutte deres oktet og opnå en stabil elektronisk konfiguration.
Elektronaffinitet:
* Halogener har en høj elektronaffinitet, hvilket indikerer mængden af energi, der frigives, når et atom får et elektron. Dette betyder, at de let accepterer elektroner og bliver negativt ladede ioner (halogenidioner).
Oxidation:
* Oxidation er processen med at miste elektroner. Når en halogen reagerer med et andet element, får den et elektron fra dette element, hvilket får det andet element til at blive oxideret (mister elektroner).
Eksempel:
Overvej reaktionen af klorgas (CL2) med natriummetal (NA):
* 2NA (S) + CL2 (G) → 2NACL (S)
I denne reaktion:
* Chlor (CL2) får et elektron fra natrium (Na), bliver et chloridion (Cl-) og bliver reduceret.
* Natrium (NA) mister en elektron, bliver en natriumion (Na+) og bliver oxideret.
Sammendrag:
Halogener er fremragende oxidationsmidler, fordi de er meget elektronegative, har en høj elektronaffinitet og accepterer let elektroner fra andre elementer, hvilket får disse elementer til at blive oxideret. Dette er grunden til, at de bruges i mange kemiske reaktioner til at indføre oxidation.
Sidste artikelKonverter 1,2 x 1024 atomer af helium til mol?
Næste artikelEr motorolie tykkere end vand?
 Varme artikler
Varme artikler
-
 Uran bryder reglerne igenKredit:University of Manchester Arbejde ledet af forskergruppen til professor Steve Liddle og offentliggjort i det prestigefyldte tidsskrift Naturkemi har rapporteret et uranditrogenmolekyle, de
Uran bryder reglerne igenKredit:University of Manchester Arbejde ledet af forskergruppen til professor Steve Liddle og offentliggjort i det prestigefyldte tidsskrift Naturkemi har rapporteret et uranditrogenmolekyle, de -
 Proteinmiljøet gør katalysatoren effektiv til brintproduktionBochum -forskerne Martin Winkler, Oliver Lampret og Thomas Happe (fra venstre mod højre) sammen med Olaf Rüdiger (i baggrunden) fra Max Planck Institute. Kredit:RUB, Marquard Interaktionen mellem
Proteinmiljøet gør katalysatoren effektiv til brintproduktionBochum -forskerne Martin Winkler, Oliver Lampret og Thomas Happe (fra venstre mod højre) sammen med Olaf Rüdiger (i baggrunden) fra Max Planck Institute. Kredit:RUB, Marquard Interaktionen mellem -
 Overvågning af syntesen af bakteriecellevæggen i realtidKredit:CC0 Public Domain Et væsentligt gennembrud er netop blevet gjort i biokemiens verden:Et hold af internationale forskere har udviklet en revolutionerende metode til i realtid at overvåge et
Overvågning af syntesen af bakteriecellevæggen i realtidKredit:CC0 Public Domain Et væsentligt gennembrud er netop blevet gjort i biokemiens verden:Et hold af internationale forskere har udviklet en revolutionerende metode til i realtid at overvåge et -
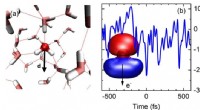 Stærke felter og ultrahurtige bevægelser - hvordan man genererer og styrer elektroner i flydende v…(a) Øjebliksbillede af arrangementet af vandmolekyler i væsken (rød:oxygenatomer, grå; hydrogenatomer). De stiplede linjer angiver hydrogenbindinger mellem molekylerne. Hvert vandmolekyle har et elekt
Stærke felter og ultrahurtige bevægelser - hvordan man genererer og styrer elektroner i flydende v…(a) Øjebliksbillede af arrangementet af vandmolekyler i væsken (rød:oxygenatomer, grå; hydrogenatomer). De stiplede linjer angiver hydrogenbindinger mellem molekylerne. Hvert vandmolekyle har et elekt
- Egenskaber af Nylon
- Sådan beskytter du Wildlife
- Sådan beregnes Helical Length
- Undersøgelser i Bangladesh beskriver, hvordan genbrug af e-affald udsætter arbejdere for kemikalie…
- Ny rekord opnået i terahertz -pulsgenerering
- Forskere bygger tyndest mulige lysdioder for at være stærkere, mere energieffektiv


