Hvordan sammenlignes partiklerne i et amorf fast stof med dem et krystallinsk fast stof?
Krystallinske faste stoffer:
* Meget bestilt: Partikler (atomer, ioner eller molekyler) er arrangeret i en regelmæssig, gentagne tredimensionelle mønster kaldet et krystalgitter.
* rækkefølge: Dette mønster strækker sig over hele faste stoffer.
* skarpt smeltepunkt: På grund af den ensartede struktur smelter de ved en bestemt temperatur.
* Eksempler: Salt (NaCl), diamanter, kvarts, is.
amorfe faste stoffer:
* forstyrret: Partikler mangler et regelmæssigt, gentagne arrangement. De har ordre på kort rækkevidde (atomer er tæt på hinanden), men ingen lang rækkevidde.
* Tilfældig arrangement: Partikler er arrangeret på en mere tilfældig, "glasagtig" måde.
* gradvis blødgøring: De har ikke et skarpt smeltepunkt. I stedet blødgør de gradvist over et temperaturområde.
* Eksempler: Glas, gummi, plast, amorf silica.
Her er en nyttig analogi:
* Tænk på et krystallinsk fast stof som en perfekt stablet kasse med appelsiner. Oranges er alle arrangeret i et pænt, forudsigeligt mønster.
* Tænk på et amorf fast stof som en bunke sand. Sandkornene er tæt på hinanden, men der er ingen klar, gentagne arrangement.
Nøgleforskelle i et nøddeskal:
| Funktion | Krystallinske faste stoffer | Amorfe faste stoffer |
| ------------------- | -------------------- | ----------------------- |
| Partikelarrangement | Højt bestilt, gentagne mønster | Forstyrret, tilfældigt arrangement |
| Bestil | Langtræksordre | Kort rækkevidde ordre |
| Smeltepunkt | Skarp, specifik temperatur | Gradvis blødgøring |
Fortæl mig, hvis du gerne vil have flere detaljer om et specifikt aspekt!
 Varme artikler
Varme artikler
-
 Undersøgelse af, hvordan tilføjelse af UV-behandling til vandklorering faktisk kan øge giftig tri…Kredit:He Zhao, Ching-Hua Huang, Chen Zhong, Penghui Du, Peizhe Sun Halobenzoquinoner (HBQer), som nye nye desinfektionsbiprodukter (DBPer), påvises ofte i drikkevand og svømmebassiner. Faktisk er
Undersøgelse af, hvordan tilføjelse af UV-behandling til vandklorering faktisk kan øge giftig tri…Kredit:He Zhao, Ching-Hua Huang, Chen Zhong, Penghui Du, Peizhe Sun Halobenzoquinoner (HBQer), som nye nye desinfektionsbiprodukter (DBPer), påvises ofte i drikkevand og svømmebassiner. Faktisk er -
 Simuleringer forklarer detonationsegenskaber i TATBAll-atom-modellering afslører, at TATB-sprængstoffer danner meget reaktive forskydningsbånd af uordnet materiale, når de stødes til detonationsforhold, peger på en tidligere ikke registreret tændkilde
Simuleringer forklarer detonationsegenskaber i TATBAll-atom-modellering afslører, at TATB-sprængstoffer danner meget reaktive forskydningsbånd af uordnet materiale, når de stødes til detonationsforhold, peger på en tidligere ikke registreret tændkilde -
 Små implantater til celler er funktionelle in vivoKunstige organeller i scavenger-cellerne hos en zebrafisk, der blev gjort synlige ved en fluorescerende reaktion. Fluorescensen opstår kun, når det indesluttede peroxidaseenzym aktiveres og reagerer m
Små implantater til celler er funktionelle in vivoKunstige organeller i scavenger-cellerne hos en zebrafisk, der blev gjort synlige ved en fluorescerende reaktion. Fluorescensen opstår kun, når det indesluttede peroxidaseenzym aktiveres og reagerer m -
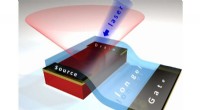 Lys fra en eksotisk krystalhalvleder kan føre til bedre solcellerKonceptuelt billede af en transistorenhed, der styrer fotoluminescens (den lyserøde kegle), der udsendes af en hybrid perovskitkrystal (den røde boks), der exciteres af en blå laserstråle, efter at sp
Lys fra en eksotisk krystalhalvleder kan føre til bedre solcellerKonceptuelt billede af en transistorenhed, der styrer fotoluminescens (den lyserøde kegle), der udsendes af en hybrid perovskitkrystal (den røde boks), der exciteres af en blå laserstråle, efter at sp
- Genredigering i hjernen får en stor opgradering
- Facebook bruger mere varme for at muliggøre politiske løgne
- Hvad er 208 Spændingsstjerne?
- Nyligt opdaget protein kunne bruges til at producere livreddende svampemidler
- Hvordan er overfladen af planeten Jupiter?
- Materialer, der bruges til fremstilling af plastposer


