Genredigering i hjernen får en stor opgradering
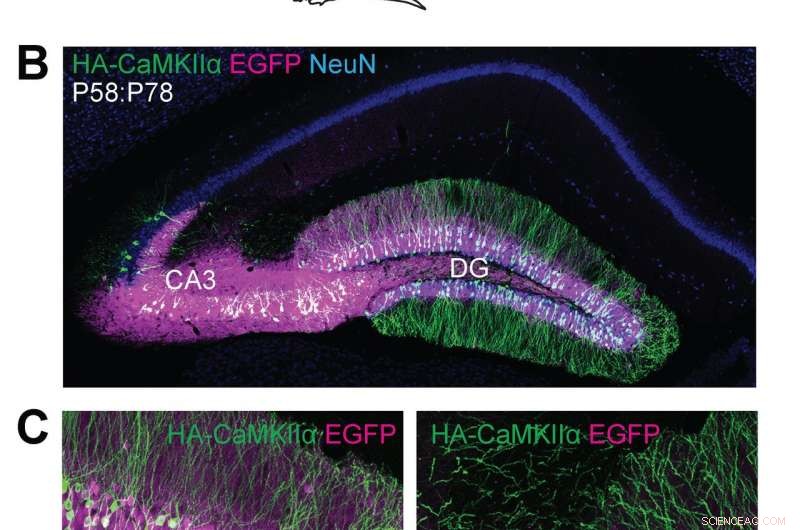
(A) Skematiske illustrationer af eksperimenter. (B, C) Konfokale mikroskopiske billeder af koronale hjernesektioner af hippocampus af Cas9 mus, viser EGFP-fluorescensen (B, C, magenta), immunreaktivitet for NeuN (B, blå) og HA-mærket (B, C, grøn) fusioneret til N-terminalen af endogen CaMKIIα. Kredit:Max Planck Florida Institute for Neuroscience
Genom redigeringsteknologier har revolutioneret biomedicinsk videnskab, giver en hurtig og nem måde at ændre gener på. Imidlertid, teknikken, der gør det muligt for videnskabsmænd at udføre de mest præcise redigeringer, virker ikke i celler, der ikke længere deler sig - hvilket omfatter de fleste neuroner i hjernen. Denne teknologi havde begrænset anvendelse i hjerneforskning, indtil nu. Forskningsstipendiat Jun Nishiyama, M.D., Ph.D., Forsker, Takayasu Mikuni, M.D., Ph.D., og videnskabelig direktør, Ryohei Yasuda, Ph.D. på Max Planck Florida Institute for Neuroscience (MPFI) har udviklet et nyt værktøj, der, for første gang, tillader præcis genomredigering i modne neuroner, åbner op for store nye muligheder inden for neurovidenskabelig forskning.
Dette nye og kraftfulde værktøj bruger den nyopdagede genredigeringsteknologi fra CRISPR-Cas9, en viral forsvarsmekanisme, der oprindeligt findes i bakterier. Når den placeres inde i en celle, såsom en neuron, CRISPR-Cas9-systemet virker ved at beskadige DNA på et specifikt målrettet sted. Cellen reparerer derefter denne skade ved hjælp af overvejende to modsatrettede metoder; en er ikke-homolog endeforbindelse (NHEJ), som har tendens til at være fejltilbøjelig, og homologi rettet reparation (HDR), som er meget præcis og i stand til at gennemgå specificerede genindsættelser. HDR er den mere ønskede metode, giver forskere fleksibilitet til at tilføje, modificere, eller slet gener afhængigt af det tilsigtede formål.
Det har været ret udfordrende at lokke celler i hjernen til fortrinsvis at gøre brug af HDR DNA-reparationsmekanismen. HDR blev oprindeligt antaget kun at være tilgængelig som en reparationsrute for aktivt prolifererende celler i kroppen. Når forløberhjerneceller modnes til neuroner, de omtales som postmitotiske eller ikke-delende celler, gør den modne hjerne stort set utilgængelig for HDR - eller det troede forskere tidligere. Holdet har nu vist, at det er muligt for post-mitotiske neuroner i hjernen aktivt at gennemgå HDR, kalder strategien "vSLENDR (viral medieret enkeltcellemærkning af endogene proteiner ved CRISPR-Cas9-medieret homologi-styret reparation)." Den kritiske nøgle til succes med denne proces er den kombinerede brug af CRISPR-Cas9 og en virus.
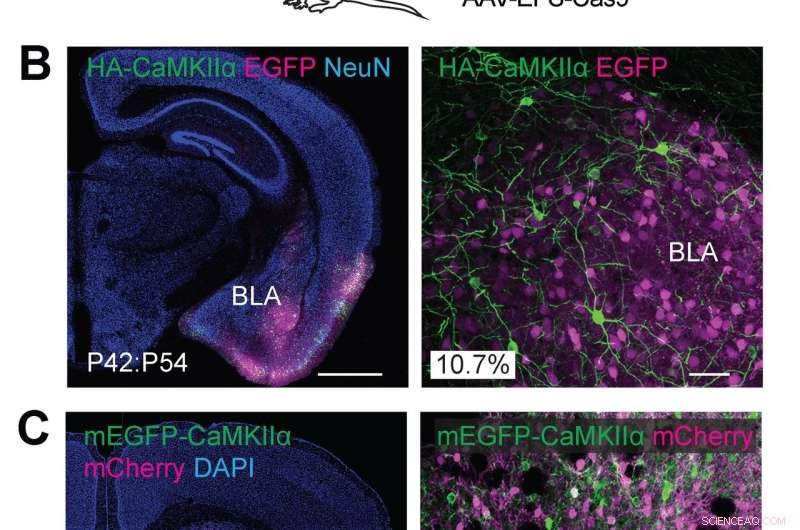
(A) Skematiske illustrationer af eksperimenter. (B) Konfokale mikroskopiske billeder af koronale hjernesektioner af amygdala af vildtype mus, viser EGFP-fluorescensen (B, magenta), immunreaktiviteter for NeuN (venstre) og HA-mærket (grønt) fusioneret til N-terminalen af endogen CaMKIIα. (C) Konfokale mikroskopiske billeder af koronale hjernesektioner af striatum af vildtype mus, viser DAPI-signal (venstre), mCherry fluorescens (magenta), mEGFP-fluorescensen (grøn) fusioneret til N-terminalen af endogent CaMKIIa. Kredit:Max Planck Florida Institute for Neuroscience
Adeno-associeret virus (AAV) er et lavt immunogent, ikke-toksisk virus brugt af videnskabsmænd som en effektiv leveringsmekanisme for alle slags gener. Denne virus kan effektivt levere den donorskabelon, der er nødvendig for HDR, øge dens effektivitet. Holdet pakkede først det nødvendige maskineri til genomredigering ind i AAV og leverede det til neuroner af transgene Cas9-udtrykkende mus, opnåelse af spektakulært effektiv HDR i post-mitotiske neuroner i hjernen.
De skabte derefter et dual-viralt system, der giver dem mulighed for at bruge teknologien i dyr, der ikke var blevet konstrueret til at udtrykke Cas9. De testede dette dual-virale system i en gammel musemodel med Alzheimers sygdom, hvilket viste, at vSLENDR-teknikken kan anvendes i patologiske modeller selv i fremskredne aldre.
vSLENDR er et kraftfuldt nyt værktøj til både grundlæggende og translationelle videnskaber, i stand til præcis redigering af genetisk information uanset celletype, cellemodenhed, hjerneregion, eller alder. Den nye vSLENDR er mere effektiv, fleksibel, og kortfattet, giver forskere mulighed for at studere et utal af hjerneprocesser og -funktioner med hidtil uset lethed. Lige så vigtigt er dets potentielle anvendelse i neuropatologiske sygdomsmodeller, fremskynde forskning og udvikling af nye terapeutiske midler; etablerer nutidens grundvidenskab som grundlaget for morgendagens kure.
Undersøgelsen er publiceret i Neuron .
 Varme artikler
Varme artikler
-
 Er børn gladere end voksne?Er det sådan du husker barndommen - alle smil og konfetti? Ryan McVay/Lifesize/Getty Images Set fra en voksen synspunkt, børn får det lavet. Hvad skal de stresses over? Pre-teenagebørn bruger deres d
Er børn gladere end voksne?Er det sådan du husker barndommen - alle smil og konfetti? Ryan McVay/Lifesize/Getty Images Set fra en voksen synspunkt, børn får det lavet. Hvad skal de stresses over? Pre-teenagebørn bruger deres d -
 En kraftdrevet mekanisme til at etablere cellepolaritetFigur:Sammentrækning driver PAR-proteinklyngning til at bryde symmetri i et C. elegans-embryo. Det øverste billede viser den kontraktile aktivitet af kortikalt myosin, som forårsager klyngedannelse af
En kraftdrevet mekanisme til at etablere cellepolaritetFigur:Sammentrækning driver PAR-proteinklyngning til at bryde symmetri i et C. elegans-embryo. Det øverste billede viser den kontraktile aktivitet af kortikalt myosin, som forårsager klyngedannelse af -
 Lizard release bringer sjældne arter tilbage til deres naturlige habitat i StorbritannienSouthampton PhD-forsker Rachel Gardner vil nøje overvåge en koloni af sjældne sandfirben. Kredit:University of Southampton En ph.d. forsker fra University of Southampton vil nøje overvåge en popul
Lizard release bringer sjældne arter tilbage til deres naturlige habitat i StorbritannienSouthampton PhD-forsker Rachel Gardner vil nøje overvåge en koloni af sjældne sandfirben. Kredit:University of Southampton En ph.d. forsker fra University of Southampton vil nøje overvåge en popul -
 Havagurkens genom peger på gener til vævsregenereringSelvom det måske ikke ser den del ud, denne holothuroid - eller havagurk - er en relativt tæt fætter til hvirveldyr, og en værdsat delikatesse på asiatiske fisk og skaldyrsmarkeder. Den har også den u
Havagurkens genom peger på gener til vævsregenereringSelvom det måske ikke ser den del ud, denne holothuroid - eller havagurk - er en relativt tæt fætter til hvirveldyr, og en værdsat delikatesse på asiatiske fisk og skaldyrsmarkeder. Den har også den u
- Sådan tager du 24 tal og beregner alle kombinationer
- Isolerende mursten med mikroskopiske bobler
- Ny økonomisk model kan forhindre problemer med kapitalstrømmen
- Eksperimenter kan hjælpe med at vurdere risici ved faldende rumsten
- Ny nanoteknisk strategi viser potentiale for forbedret avanceret energilagring
- Ny rapport anbefaler en landsdækkende indsats for bedre at estimere metanudledningen


