En kraftdrevet mekanisme til at etablere cellepolaritet
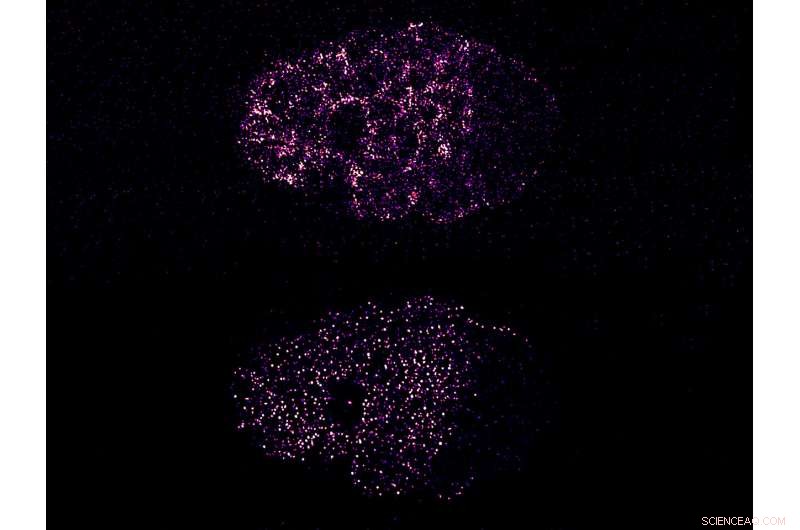
Figur:Sammentrækning driver PAR-proteinklyngning til at bryde symmetri i et C. elegans-embryo. Det øverste billede viser den kontraktile aktivitet af kortikalt myosin, som forårsager klyngedannelse af PAR-3-protein (nederste billede). Både myosin og PAR-3 adskiller sig i venstre side af embryoet, den forreste pol. Dette bryder den tidligere symmetriske fordeling af disse proteiner og polariserer cellen. Kredit:Mechanobiology Institute, Singapore
Et team af forskere fra Mechanobiology Institute, Singapore (MBI) ved National University of Singapore, sammen med kolleger fra Temasek Life Sciences Laboratory og A*STAR's Institute of Molecular and Cell Biology i Singapore, har afsløret en ny mekanisme til at etablere cellepolaritet, der er afhængig af spændingskraftinduceret klyngedannelse af proteiner. Dette arbejde blev offentliggjort i det videnskabelige tidsskrift Naturens cellebiologi i august 2017.
Kortikale kræfter inducerer proteinklyngning til cellepolarisering
Biologiske celler visualiseres typisk som runde (eller sfæriske) i form, med en kerne centreret i midten, og andre cellulære komponenter spredt overalt. I virkeligheden, hver celletype udviser en særskilt form, størrelse og sammensætning. Afbildninger af symmetriske sfærer er, i det væsentlige, en oversimplificering, der skjuler det faktum, at næsten alle celler er asymmetriske i deres sammensætning, og at denne asymmetri udvikler sig i præcise og velordnede trin.
Kendt som cellepolaritet, denne nøglekarakteristik af celler ser adskillelsen af de subcellulære komponenter i distinkte regioner af cellen. Hvis celler var symmetriske, processer som deling og bevægelse af celler ville ikke forekomme korrekt, og væv og organer ville være deforme og ikke-funktionelle. På trods af at det er en integreret del af organismens udvikling, videnskabsmænd har endnu ikke fuldt ud defineret de processer, hvorved celler bliver polariseret.
En måde at visualisere den asymmetriske karakter af cellulær sammensætning er at tænke på komponenterne i en bil, og hvordan de er arrangeret. Nogle dele af bilen skal placeres i et afbalanceret layout, for eksempel hjulene. Andre komponenter skal arrangeres i en bestemt retning for at fungere korrekt, dvs. førersædet skal være placeret foran de bagerste passagersæder. Endelig, komponenter som motoren kan være placeret foran eller bag på bilen, og vigtigst af alt giver denne organisation forskellige egenskaber til bilens håndtering. På samme måde, arrangementet af cellulære komponenter kan have drastiske effekter på cellefunktionen.
Mange af de eksisterende undersøgelser af cellepolaritet er blevet udført i nematodeormen C. elegans. På encellestadiet, embryonet deler sig langs en for-/bagakse for at generere to datterceller af forskellig størrelse, med en større celle foran og en mindre celle bagpå. Denne for-/bagakse er etableret ved bevægelse og adskillelse af en gruppe proteiner kendt som PAR (partitionsdefekte) proteiner.
Disse PAR-proteiner findes i cellebarken, et dynamisk lag af proteinfilamenter, der ligger lige inde i cellemembranen. Før polarisering, PAR-proteinerne er fordelt over hele cortex, hvor de bevæger sig frit. Under polarisering, cortex trækker sig sammen, og dette får forskellige PAR-proteiner til at adskille og akkumulere på enten forsiden eller bagsiden af cellen, derved bryde deres tidligere symmetriske organisation og etablere polaritet langs for-/bagaksen. Imidlertid, mekanismen, hvormed kontraktil aktivitet transporterer og adskiller PAR-proteiner, forbliver uklar.
Spændingsflow
Holdet af forskere ledet af adjunkt Fumio Motegi, Principal Investigator ved MBI og Temasek Life Sciences Laboratory, forsøgte at besvare dette spørgsmål ved at observere bevægelsen af fluorescensmærkede PAR-proteinkomplekser under mikroskopet i levende C. elegans-embryoner, mens de gennemgik polarisering. Ved hjælp af avancerede mikroskopiteknikker, de opdagede, at visse PAR-proteiner blev samlet i klynger i begyndelsen af polarisering, og disse klynger voksede i størrelse, efterhånden som polariseringen skred frem. Når kortikal kontraktion stoppede, klyngerne adskilt, med proteinerne spredt ud som en gradient langs for-/bagaksen.
På trods af disse fund, forskerne observerede ikke en direkte forbindelse mellem de kontraktile fibre og PAR-proteiner, og dette fik dem til at antage, at en indirekte effekt af sammentrækning var ansvarlig for klyngedannelse. Ved at forstyrre eller forstærke actomoysin cortex og observere effekten på klyngedannelse, de opdagede, at nøglekraften, der driver PAR-klyngning, var kortikal spænding, som udviklede sig efterhånden som cortex trak sig sammen.
Ud fra dette var forskerne i stand til at foreslå en ny model, der forklarede segregeringen af PAR-proteiner. Her, sammentrækning af actomyosin cortex fører til en stigning i kortikal spænding, hvilket får PAR-proteinerne til at samle sig i klynger. Når disse store klynger bevæger sig langsomt, de bliver fanget i den overordnede corticale strømning og adskiller sig i den ene ende af cellen, og derved etablere polaritet. Disse adskilte klynger af PAR-proteiner fungerer derefter som et stillads, der medierer en lokal akkumulering af andre proteiner, der er nødvendige for etableringen af for-/bagakser langs kroppen.
Mekanismen opdaget i denne undersøgelse er et simpelt, men elegant eksempel på, hvordan celler bruger indre kræfter til at flytte og organisere deres proteinkomponenter på en præcis, velordnet måde. Vigtigt, den beskrevne kraftdrevne mekanisme tillader cellen at etablere polaritet uden at spilde energi ved aktivt at transportere proteiner eller cellulære komponenter mod en koncentrationsgradient. Det menes, at lignende mekanismer bruges til at bryde symmetri i andre organismer, inklusive mennesker, og det er håbet, at denne nye viden vil hjælpe videnskabsmænd med at forstå, hvordan og hvorfor cellepolaritet ikke kan etableres ordentligt i sygdomme som cystisk fibrose og cancer.
Sidste artikelDen første luksus Perigord-trøffel dyrkes i Storbritannien
Næste artikelMexico siger, at truede marsvin døde i fangenskab
 Varme artikler
Varme artikler
-
 Hvilken procentdel af knogler i kroppen overrasker det aksiale skelet?Uden støtte fra et skelet, forestil dig, hvordan den menneskelige krop ville se ud. Hovedet og bagagerumets knogler - kaldet det aksiale skelet - er især vigtige. De danner den centrale linje eller ak
Hvilken procentdel af knogler i kroppen overrasker det aksiale skelet?Uden støtte fra et skelet, forestil dig, hvordan den menneskelige krop ville se ud. Hovedet og bagagerumets knogler - kaldet det aksiale skelet - er især vigtige. De danner den centrale linje eller ak -
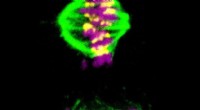 Forskere rapporterer kemisk grundlag for celledelingstimeren, et muligt mål mod kræftTo faser af kræftcelledeling. Billedet viser de replikerede kromosomer i lilla. Cellen indeholder to spindler med mikrotubuli, vist med grønt. I det øverste billede, disse mikrotubuli har knyttet sig
Forskere rapporterer kemisk grundlag for celledelingstimeren, et muligt mål mod kræftTo faser af kræftcelledeling. Billedet viser de replikerede kromosomer i lilla. Cellen indeholder to spindler med mikrotubuli, vist med grønt. I det øverste billede, disse mikrotubuli har knyttet sig -
 Hjerneløs,Fodløse slimforme er underligt intelligente og mobile Physarum polycephalum , bogstaveligt talt slimhovedet med mange hoveder, er en slimform, der er følsom over for lys og beboer skyggefuld
Hjerneløs,Fodløse slimforme er underligt intelligente og mobile Physarum polycephalum , bogstaveligt talt slimhovedet med mange hoveder, er en slimform, der er følsom over for lys og beboer skyggefuld -
 Bakterier LivscyklusBakteriets livscyklus består af forsinkelsesfasen, log- eller eksponentiel fase, den stationære fase og dødsfasen. Faktorer, der påvirker bakterievækst, bærer stærkt på denne cyklus. Lagfase Bak
Bakterier LivscyklusBakteriets livscyklus består af forsinkelsesfasen, log- eller eksponentiel fase, den stationære fase og dødsfasen. Faktorer, der påvirker bakterievækst, bærer stærkt på denne cyklus. Lagfase Bak


